
| c2(SO3) |
| c2(SO2)c(O2) |
| c2(SO3) |
| c2(SO2)c(O2) |
| x |
| 2 |
| x |
| 2 |
| x |
| 2 |
| 0.2mol |
| 2.1mol |


 星级口算天天练系列答案
星级口算天天练系列答案 芒果教辅达标测试卷系列答案
芒果教辅达标测试卷系列答案科目:高中化学 来源: 题型:
| A、稳定性:H2O>H2S>H2Se |
| B、熔点:SiO2>NaCl>I2>CO2 |
| C、酸性:HCl>HBr>HI |
| D、碱性:NaOH>Mg(OH)2>Al(OH)3 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、地球上水很少,不能满足人类的需要 |
| B、土地沙漠化,使空气中水蒸气不断减少 |
| C、由于地球表面气温的作用,水会被不断蒸发掉 |
| D、淡水资源不充足,分布又很不均匀,而且人类活动使水不断地受到污染,使淡水资源越来越紧缺 |
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
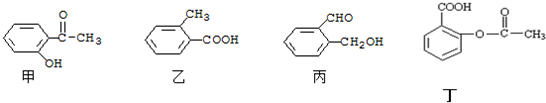
查看答案和解析>>
科目:高中化学 来源: 题型:


查看答案和解析>>
科目:高中化学 来源: 题型:
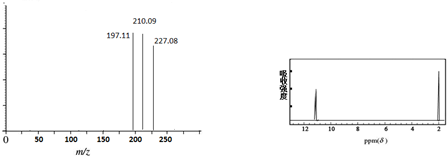
查看答案和解析>>
科目:高中化学 来源: 题型:
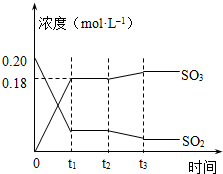 已知2SO2 (g)+O2(g)?2SO3(g)△H=-196kJ?mol-1,5000C时将2mol SO2和1molO2装入一体积恒定的10L密闭容器中,2分钟(t1)时达到平衡.如图所示:
已知2SO2 (g)+O2(g)?2SO3(g)△H=-196kJ?mol-1,5000C时将2mol SO2和1molO2装入一体积恒定的10L密闭容器中,2分钟(t1)时达到平衡.如图所示:查看答案和解析>>
科目:高中化学 来源: 题型:

查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com