
【题目】硅单质及其化合物应用范围很广。请回答下列问题:
(1)制备硅半导体材料必须先得到高纯硅。三氯甲硅烷(SiHCl3)还原法是当前制备高纯硅的主要方法,生产过程示意图如下:
![]()
①写出由纯SiHCl3制备高纯硅的化学反应方程式_____________________________。
②整个制备过程必须严格控制无水无氧。SiHCl3遇水剧烈反应生成H2SiO3、H2和另一种酸,写出并配平化学反应方程式_________________________________;H2还原SiHCl3过程中若混入O2,可能引起的后果是_________________________________________________。
(2)下列有关硅材料的说法正确的是________ 。
A.盐酸可以与硅反应,故采用盐酸为抛光液抛光单晶硅
B.氮化硅硬度大、熔点高,可用于制作高温陶瓷和轴承
C.高纯度的二氧化硅可用于制造高性能通讯材料——光导纤维
D.普通玻璃是由纯碱、石灰石和石英砂制成的,其熔点很高,硬度很大
(3)自然界中硅酸盐种类多,结构复杂,通常用二氧化硅和金属氧化物的形式来表示其组成.如正长石(KAlSi3O8),氧化物形式为_________________________________
(4)硅酸钠水溶液俗称水玻璃。取少量硅酸钠溶液于试管中,逐滴加入稀硝酸,产生的实验现象为_____________,水玻璃在工业上有许多用途,试举出一例____________________。
【答案】 SiHCl3+H2![]() Si+3HCl SiHCl3+3H2O= H2SiO3↓十3HCl↑+H2↑ 氧气与氢气混合,可能引起爆炸,氧气可能会氧化SiHCl3 B C K2O·AL2O3·6SiO2 试管中有白色胶状沉淀生成 制备硅胶、防火剂、防腐剂、粘合剂等(回答一个即可)
Si+3HCl SiHCl3+3H2O= H2SiO3↓十3HCl↑+H2↑ 氧气与氢气混合,可能引起爆炸,氧气可能会氧化SiHCl3 B C K2O·AL2O3·6SiO2 试管中有白色胶状沉淀生成 制备硅胶、防火剂、防腐剂、粘合剂等(回答一个即可)
【解析】(1)①根据原子守恒即质量守恒可知,三氯甲硅烷(SiHCl3)与H2反应生成硅和氯化氢,反应的化学方程式为:SiHCl3+H2![]() Si+3HCl;②SiHCl3和H2O剧烈反应生成H2SiO3、HCl和另一种物质,分析它们化合价的变化可知,
Si+3HCl;②SiHCl3和H2O剧烈反应生成H2SiO3、HCl和另一种物质,分析它们化合价的变化可知,![]() ,而Cl的化合价未发生变化,因此另一种元素即H元素的化合价必定降低,即另一种物质是H2,故反应方程式为SiHCl3+3H2O= H2SiO3↓十3HCl↑+H2↑;H2还原SiHCl3过程中若混入O2,可能引起的后果是氧气与氢气混合,可能引起爆炸,氧气可能会氧化SiHCl3;(2)A、盐酸不能与硅反应,而HCl在573 K以上的温度下可与硅发生反应,选项A错误;B、氮化硅为原子晶体,熔点高,性质稳定,可用于制作高温陶瓷和轴承,选项B正确;C.高纯度的二氧化硅可用于制造高性能通讯材料——光导纤维,选项C正确;D、玻璃是一种玻璃态物质,无固定的熔点,选项D错误。答案选BC;(3)正长石(KAlSi3O8)改写成氧化物的形式为:K2O·AL2O3·6SiO2;(4)硅酸钠水溶液俗称水玻璃。取少量硅酸钠溶液于试管中,逐滴加入稀硝酸,产生的实验现象为试管中有白色胶状沉淀生成,水玻璃在工业上有许多用途,如制备硅胶、防火剂、防腐剂、粘合剂等。
,而Cl的化合价未发生变化,因此另一种元素即H元素的化合价必定降低,即另一种物质是H2,故反应方程式为SiHCl3+3H2O= H2SiO3↓十3HCl↑+H2↑;H2还原SiHCl3过程中若混入O2,可能引起的后果是氧气与氢气混合,可能引起爆炸,氧气可能会氧化SiHCl3;(2)A、盐酸不能与硅反应,而HCl在573 K以上的温度下可与硅发生反应,选项A错误;B、氮化硅为原子晶体,熔点高,性质稳定,可用于制作高温陶瓷和轴承,选项B正确;C.高纯度的二氧化硅可用于制造高性能通讯材料——光导纤维,选项C正确;D、玻璃是一种玻璃态物质,无固定的熔点,选项D错误。答案选BC;(3)正长石(KAlSi3O8)改写成氧化物的形式为:K2O·AL2O3·6SiO2;(4)硅酸钠水溶液俗称水玻璃。取少量硅酸钠溶液于试管中,逐滴加入稀硝酸,产生的实验现象为试管中有白色胶状沉淀生成,水玻璃在工业上有许多用途,如制备硅胶、防火剂、防腐剂、粘合剂等。


科目:高中化学 来源: 题型:
【题目】公元前一世纪,我国已使用天然气,天然气的主要成分为甲烷。下列关于甲烷的叙述中,错误的是
A. 通常情况下,甲烷跟强酸、强碱、强氧化剂不起反应
B. 甲烷化学性质比较稳定,不能被任何氧化剂氧化
C. 甲烷跟氧气反应无论生成CH3Cl、CH2Cl、CHCl3还是CCl4,都属于取代反应
D. 甲烷的四种取代物都难溶于水
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】2015年初,雾霾天气多次肆虐我国中东部地区,其中汽车尾气是造成空气污染的主要原因,汽车尾气净化的主要原理为:
2NO(g)+2CO(g) ![]() 2CO2(g)+N2(g).在密闭容器中发生该反应时,c(CO2)随温度(T)、催化剂的表面积(S)和时间(t)的变化曲线如图1所示.
2CO2(g)+N2(g).在密闭容器中发生该反应时,c(CO2)随温度(T)、催化剂的表面积(S)和时间(t)的变化曲线如图1所示.
(1)该反应的△H0(选填“>”、“<”).
(2)在T2温度下,0~2s内的平均反应速率v(N2)= .
(3)当固体催化剂的质量一定时,增大其表面即可提高化学反应速率,若催化剂的表面积S1>S2 , 在图1中画出c(CO2)在T1、S2条件下达到平衡过程中的变化曲线. 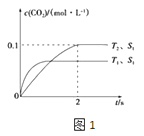
(4)若该反应在绝热、恒容的密闭体系中进行,图2的示意图正确且能说明反应在t1时刻处于化学平衡状态的是(填代号). 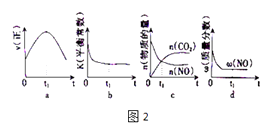
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】如图是用稀硝酸和Cu制取少量NO并验证氮氧化合物性质的装置。下列说法不正确的是( )
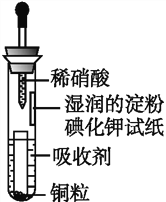
A. 吸收剂可以是NaOH溶液
B. 试管上部的气体始终为无色
C. 小试管中溶液最终呈蓝色
D. 试纸最终呈蓝色
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】两种气态烃组成的混合气体0.1mol,完全燃烧得0.16mol CO2和3.6g H2O,下列说法正确的是( )
A.一定有乙烷
B.一定是甲烷和乙烯
C.一定有甲烷
D.一定有乙炔
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列关于阿伏加德罗常数的说法不正确的是( )
A.阿伏加德罗常数是一个纯数,没有单位
B.常用NA表示阿伏加德罗常数
C.阿伏加德罗常数是一个实验值
D.阿伏加德罗常数常用:6.02×1023mol﹣1
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】实验室制备1,2﹣二溴乙烷的反应原理如下:
CH3CH2OH ![]() CH2═CH2
CH2═CH2
CH2═CH2+Br2→BrCH2CH2Br
可能存在的主要副反应有:乙醇在浓硫酸的存在下在l40℃脱水生成乙醚.用少量的溴和足量的乙醇制备1,2﹣二溴乙烷的装置如图所示:
有关数据列表如下:
乙醇 | 1,2﹣二溴乙烷 | 乙醚 | |
状态 | 无色液体 | 无色液体 | 无色液体 |
密度/gcm﹣3 | 0.79 | 2.2 | 0.71 |
沸点/℃ | 78.5 | 132 | 34.6 |
熔点/℃ | 一l30 | 9 | ﹣1l6 |
回答下列问题: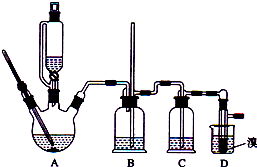
(1)在此制各实验中,要尽可能迅速地把反应温度提高到170℃左右,其最主要目的是;(填正确选项前的字母)
a.引发反应 b.加快反应速度 c.防止乙醇挥发 d.减少副产物乙醚生成
(2)在装置C中应加入 , 其目的是吸收反应中可能生成的酸性气体:(填正确选项前的字母)
a.水 b.浓硫酸 c.氢氧化钠溶液 d.饱和碳酸氢钠溶液
(3)判断该制备反应已经结束的最简单方法是;
(4)将1,2﹣二溴乙烷粗产品置于分液漏斗中加水,振荡后静置,产物应在层(填“上”、“下”);
(5)若产物中有少量未反应的Br2 , 最好用洗涤除去;(填正确选项前的字母)
a.水 b.氢氧化钠溶液 c.碘化钠溶液 d.乙醇
(6)若产物中有少量副产物乙醚.可用的方法除去;
(7)反应过程中应用冷水冷却装置D,其主要目的是;但又不能过度冷却(如用冰水),其原因是 .
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com