
【题目】有A,B,C,D,E五种元素,其中A,B,C,D为短周期元素,A元素的周期数、主族数、原子序数相同;B原子核外有3种能量不同的原子轨道且每种轨道中的电子数相同;C原子的价电子构型为csccpc+1,D元素的原子最外层电子数比次外层电子数少2个,D的阴离子与E的阳离子电子层结构相同,D和E可形成化合物E2D.
(1)上述元素中,第一电离能最小的元素的原子结构示意图为__;D的价电子排布图为__;
(2)下列分子结构图中的●和○表示上述元素的原子中除去最外层电子的剩余部分,小黑点表示没有形成共价键的最外层电子,短线表示共价键.

则在以上分子中,中心原子采用sp3杂化形成化学键的是__(填写分子的化学式); 在③的分子中有__个σ键和__个π键.
(3)A,C,D可形成既具有离子键又具有共价键的化合物,其化学式可能为__;足量的C的氢化物水溶液与CuSO4溶液反应生成的配合物,其化学式为__,请说出该配合物中中心原子与配位体及内界与外界之间的成键情况:__.
【答案】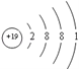
![]() NH3、CH4、H2S 5 1 NH4HS或(NH4)2S [Cu(NH3)4]SO4 内界中铜离子与氨分子之间以配位键相结合,外界铜氨络离子与硫酸根离子之间以离子键相结合
NH3、CH4、H2S 5 1 NH4HS或(NH4)2S [Cu(NH3)4]SO4 内界中铜离子与氨分子之间以配位键相结合,外界铜氨络离子与硫酸根离子之间以离子键相结合
【解析】
由于A,B,C,D为短周期元素,因A元素的周期数、主族数、原子序数相同,则A只能为氢元素;同一能层的不同能级的能量不同,符号相同的能级处于不同能层时能量也不同,即1s、2s、2p的轨道能量不同,2p有3个能量相同的轨道,由此可确定B;因s轨道最多只能容纳2个电子,所以c=2,即C原子价电子构型为2s22p3,即氮元素。短周期中原子的次外层只可能是K或L层,K、L层最多容纳2个或8个电子,据此可确定D。再由D的阴离子电子数及在E2D中E的化合价,即可确定E。由此分析。
由于A,B,C,D为短周期元素,A元素的周期数、主族数、原子序数相同,则A为氢元素;B原子核外有3种能量不同的原子轨道且每种轨道中的电子数相同,则B的电子排布式为1s22s23p2,即B为碳元素;因s能级最多只能容纳2个电子,即c=2,所以C原子价电子构型为2s22p3,C为氮元素;短周期中原子的次外层只可能是K或L层,K、L层最多容纳2个或8个电子,因D原子最外层电子数比次外层电子数少2个,所以D的次外层只能是L层,D的最外层应为6个电子,即D为16号元素硫;硫元素的阴离子(S2-)有18个电子,E阳离子也应有18个电子,在E2D中E显+1价,所以E为19号元素钾。所以A、B、C、D、E分别为氢、碳、氮、硫、钾。
(1)上述五种元素中金属性最强的是钾元素,故它的第一电离能最小,其原子结构示意图为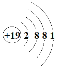 。硫原子价电子层为M层,价电子排布式为3s23p4,其电子排布图为
。硫原子价电子层为M层,价电子排布式为3s23p4,其电子排布图为![]() 。
。
(2)①分子结构图中黑点表示的原子最外层有5个电子,显然是氮原子,白球表示的原子最外层只有1个电子,是氢原子,所以该分子是NH3,中心N原子有3个σ键,1个孤电子对,故采用sp3杂化;②分子中黑球表示的原子最外层4个电子,是碳原子,白球表示的原子的最外层只有1个电子,是氢原子,所以②分子是CH4,中心碳原子有4个σ键,0个孤电子对,采用sp3杂化;③分子中黑球表示的原子最外层4个电子,是碳原子,白球表示的原子的最外层只有1个电子,是氢原子,所以③分子是CH2=CH2,中心碳原子有3个σ键,0个孤电子对,所以中心原子采用sp2杂化;④分子中黑球表示的原子最外层6个电子,是硫原子,白球表示的原子的最外层只有1个电子,是氢原子,该分子为H2S,中心S原子有2个σ键,2个孤电子对,所以中心原子采用sp3杂化。因此中心原子采用sp3杂化形成化学键的分子有NH3、CH4、H2S。在CH2=CH2的分子中有5个σ键和1个π键。
(3)根据上面的分析知A、C、D分别为氢、氮、硫三种元素,形成既具有离子键又具有共价键的化合物是硫氢化铵或硫化铵,其化学式为NH4HS或(NH4)2S,铵根与HS-或S2-之间是离子键,铵根中的N与H之间是共价键,HS-中H与S之间是共价键。C的氢化物是NH3,NH3的水溶液与CuSO4溶液反应生成的配合物是硫酸四氨合铜,其化学式为[Cu(NH3)4]SO4。配合物[Cu(NH3)4]SO4的内界中Cu2+与NH3之间是以配位键相结合,外界铜氨配离子[Cu(NH3)4]2+与硫酸根离子之间是以离子键相结合。


 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案科目:高中化学 来源: 题型:
【题目】在某容积一定的密闭容器中,可逆反应:A(g)+B(g)![]() xC(g),符合下列图象(Ⅰ)所示关系。由此推断对图(Ⅱ)的正确说法是( )
xC(g),符合下列图象(Ⅰ)所示关系。由此推断对图(Ⅱ)的正确说法是( )
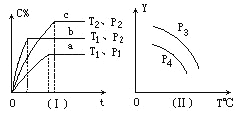
A. P3>P4,Y轴表示A的质量
B. P3<P4,Y轴表示B的百分含量
C. P3>P4,Y轴表示混合气体密度
D. P3>P4,Y轴表示混合气体平均摩尔质量
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】如图为几种晶体或晶胞的示意图:


请回答下列问题:
(1)上述晶体中,粒子之间以共价键结合形成的晶体是____。
(2)冰、金刚石、MgO、CaCl2、干冰5种晶体的熔点由高到低的顺序为:___。
(3)NaCl晶胞与MgO晶胞相同,NaCl晶体的晶格能___(填“大于”或“小于”)MgO晶体,原因是____。
(4)每个Cu晶胞中实际占有___个Cu原子,CaCl2晶体中Ca2+的配位数为__。
(5)冰的熔点远高于干冰,除H2O是极性分子、CO2是非极性分子外,还有一个重要的原因是_____。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】
化合物G是治疗高血压的药物“比索洛尔”的中间体,一种合成G的路线如下:

已知以下信息:
①A的核磁共振氢谱为单峰;B的核磁共振氢谱为三组峰,峰面积比为6∶1∶1。
②D的苯环上仅有两种不同化学环境的氢;1molD可与1mol NaOH或2mol Na反应。
回答下列问题:
(1)A的结构简式为____________。
(2)B的化学名称为____________。
(3)C与D反应生成E的化学方程式为____________。
(4)由E生成F的反应类型为____________。
(5)G是分子式为____________。
(6)L是D的同分异构体,可与FeCl3溶液发生显色反应,1mol的L可与2mol的Na2CO3反应,L共有______种;其中核磁共振氢谱为四组峰,峰面积比为3∶2∶2∶1的结构简式为___________、____________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在周期表中,同一主族元素化学性质相似。目前也发现有些元素的化学性质和它在周期表中左上方或右下方的另一主族元素性质相似,这称为对角线规则。据此请回答:
(1)锂在空气中燃烧,除生成________(填化学式,下同)外,也生成微量的________。
(2)铍的最高价氧化物对应的水化物的化学式是________,属两性化合物,证明这一结论的有关离子方程式为_________。
(3)若已知反应Be2C+4H2O=2Be(OH)2+CH4↑,则Al4C3遇足量强碱溶液反应的离子方程式为________。
(4)科学家证实,BeCl2是共价化合物,设计一个简单实验证明,其方法是_______。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】亚甲基蓝(Methylnene Blue)在碱性条件下与葡萄糖作用生成亚甲基白(Methylene White),亚甲基蓝的结构简式:
著名的蓝瓶子实验操作步骤如下:
①如图示在250mL锥形瓶中,依次加入2g NaOH、100mL H2O和3g葡萄糖,搅拌溶解后,再加入3滴~5滴0.2%的亚甲基蓝溶液,振荡混合液呈现蓝色;
②塞紧橡皮塞(活塞a、b关闭),将溶液静置,溶液变为无色;
③再打开瓶塞,振荡,溶液又变为蓝色;
④再塞紧橡皮塞,将溶液静置,溶液又变为无色,以上③、④可重复多次。
试回答下列问题:

(1)某学生将起初配得的蓝色溶液分装在A,B两支试管中(如上图,A试管充满溶液,B中有少量溶液),塞上橡皮塞静置片刻,两溶液均显无色,若再同时振荡A,B试管,能显蓝色的是_________(填“A”或“B”);
(2)若塞紧锥形瓶塞并打开活塞a、b,通入足量氢气后,再关闭活塞a、b并振荡,溶液能否由无色变为蓝色_________(填“能”或“不能”);若塞紧锥形瓶塞并打开a、b通入足量氧气,溶液能否由无色变为蓝色_________(填“能”或“不能”);
(3)上述转化过程中,葡萄糖的作用是_________,亚甲基蓝的作用是_________;
(4)上述实验中葡萄糖也可用鲜橙汁(其中含丰富维生素C)代替,这是因为维生素C具有_____;
(5)该实验中③、④操作能否无限次重复进行_________(填“能”或“不能”),理由是 _____。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】2012年4月,中央电视台曝光了不法商贩将重金属铬![]() 超标的工业明胶加工成药用胶囊的“毒胶囊”事件.已知铬的原子序数为24,下列叙述正确的是
超标的工业明胶加工成药用胶囊的“毒胶囊”事件.已知铬的原子序数为24,下列叙述正确的是
A.铬位于元素周期表的第四周期第Ⅷ族
B.警察通过装有橙色的酸性重铬酸钾的装置检查司机是否酒后驾车
C.已知铬元素的一种同位素的质量数为53,则该同位素有53个中子
D.中子数为29的铬原子符号表示为![]()
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】如图为几种晶体或晶胞的示意图:


请回答下列问题:
(1)上述晶体中,粒子之间以共价键结合形成的晶体是____。
(2)冰、金刚石、MgO、CaCl2、干冰5种晶体的熔点由高到低的顺序为:___。
(3)NaCl晶胞与MgO晶胞相同,NaCl晶体的晶格能___(填“大于”或“小于”)MgO晶体,原因是____。
(4)每个Cu晶胞中实际占有___个Cu原子,CaCl2晶体中Ca2+的配位数为__。
(5)冰的熔点远高于干冰,除H2O是极性分子、CO2是非极性分子外,还有一个重要的原因是_____。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列有关的离子方程式或化学方程式中正确的是
A.向![]() 溶液中加入过量NaOH溶液,有白色沉淀生成:
溶液中加入过量NaOH溶液,有白色沉淀生成:![]()
B.磷酸一氢钠溶液水解:![]()
C.将![]() 气体通入一密闭容器中,达平衡后吸收QkJ热量,则该反应的热化学方程式为:
气体通入一密闭容器中,达平衡后吸收QkJ热量,则该反应的热化学方程式为:![]()
![]()
D.向含有![]() mol
mol![]() 的溶液中通入
的溶液中通入![]() mol
mol![]() 充分反应:
充分反应:![]()
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com