
【题目】25℃时,下列各组离子在指定溶液中一定能大量共存的是( )
A.能使甲基橙变红的溶液中:K+、Mg2+、NO3-、I-
B.c(HCO3-)=1 mol·L-1溶液中:Na+、Al3+、SO42-、Cl-
C.无色透明的溶液中:Fe3+、Al3+、NO3-、SO42-
D.常温下,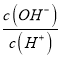 =10-10的溶液中:K+、Na+、I-、SO42-
=10-10的溶液中:K+、Na+、I-、SO42-
【答案】D
【解析】
离子若不能发生任何反应,且与题干选项要求不产生影响,就可以大量共存,否则不能大量存在。
A.能使甲基橙变红的溶液显酸性,含有大量的H+,H+、NO3-、I-会发生氧化还原反应,不能大量共存,A错误;
B.c(HCO3-)=1 mol·L-1溶液中:HCO3-、Al3+会发生双水解反应生成Al(OH)3沉淀和CO2气体,不能大量共存,B错误;
C.无色透明的溶液中不能含有大量的Fe3+,含有铁离子的溶液呈黄色,C错误;
D.常温下,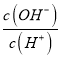 =10-10的溶液显酸性,含有大量的H+,H+与选项中K+、Na+、I-、SO42-均不发生任何反应,可以大量共存,D正确;
=10-10的溶液显酸性,含有大量的H+,H+与选项中K+、Na+、I-、SO42-均不发生任何反应,可以大量共存,D正确;
故合理选项是D。


 开心快乐假期作业暑假作业西安出版社系列答案
开心快乐假期作业暑假作业西安出版社系列答案 名题训练系列答案
名题训练系列答案 期末集结号系列答案
期末集结号系列答案科目:高中化学 来源: 题型:
【题目】氟利昂在光照下会产生氯原子自由基,对臭氧的分解有催化作用,该反应的能量变化如图所示,则下列说法不正确的是( )
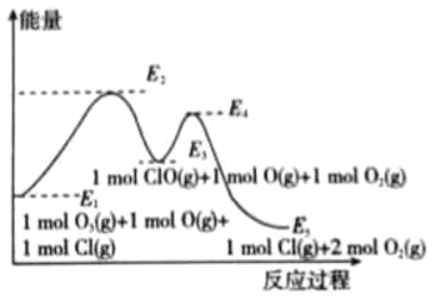
A.催化剂不改变总反应的热效应△H
B.催化剂催化反应过程为:O3(g)+Cl(g)=ClO(g)+O2(g),ClO(g)+O(g)=Cl(g)+O2(g)
C.总反应:O3(g)+O(g)═2O2(g)△H=(E1﹣E5)
D.各1 mol反应物O3(g)与Cl(g)的总能量低于各1mol生成物ClO(g)与O2(g)的总能量
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知W、X、Y、Z为短周期元素,W、Z同主族,X、Y、Z同周期,W的气态氢化物的稳定性大于Z的气态氢化物稳定性,X、Y为金属元素,X的阳离子的氧化性小于Y的阳离子的氧化性,下列说法正确的是
A. X、Y、Z、W的原子半径依次减小
B. W与X形成的化合物中只含离子键
C. W的气态氢化物的沸点一定高于Z的气态氢化物的沸点
D. 若W与Y的原子序数相差5,则二者形成化合物的化学式一定为Y2W3
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某温度时,CuS、MnS在水中的沉淀溶解平衡曲线如图所示。下列说法错误的是( )
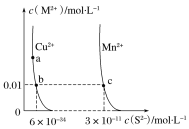
A.该温度下,Ksp(CuS)小于Ksp(MnS)
B.向CuSO4溶液中加入MnS发生如下反应:Cu2+(aq)+MnS(s)=CuS(s)+Mn2+(aq)
C.在含有CuS和MnS固体的溶液中c(Cu2+):c(Mn2+)为2×10-23:1
D.a点对应的Ksp大于b点对应的Ksp
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列反应在常温下均为非自发反应,在高温下仍为非自发的是
A. 2Ag2O(s)=4Ag(s)+O2(g)
B. 2Fe2O3(s)+3C(s)=Fe(s)+3CO2(g)
C. N2O4(g)=2NO2(g)
D. 6C(s)+6H2O(l)=C6H12O6(s)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】短周期原子序数依次递增的 A、B、C、D、E、F 六种元素,已知B 原子最外层电子数是A 原子次外层电子数的 3 倍,是 D 原子最外层电子数的 2 倍;C 原子内层电子总数是最外层电子数 10 倍;A、B、D 三种元素的原子最外层电子数之和为 13; A 和B 原子最外层电子数之和与D 和 F 原子最外层电子数之和相等; E 和 F 是相邻元素。回答下列问题:
(1)E 元素的名称为__;其在元素周期表中的位置是__。
(2)AB2 的电子式为__;用电子式表示E 的氢化物的形成过程__。
(3)C 和 F 元素的最高价氧化物的水化物反应的化学方程式为__;
(4)B、C、D、F 四种元素原子半径由大到小的顺序是__(填元素符号),离子半径最小的是__(填离子符号)。
(5)B 和 E 的简单氢化物中沸点较高的是__(填化学式),A 和B 的简单氢化物中稳定性较好的是__(填化学式)。
(6)短周期元素M 与 D 元素位于不同主族,根据对角线规则二者某些性质相似。将 M 的最高价氧化物溶于 C 的最高价氧化物对应的水化物溶液中,发生反应的离子方程式为__。
(7)由 B、C 两种元素组成的化合物有两种,其中一种为淡黄色,该物质的电子式为__。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】(1)计算调控值:
室温下,当溶液中c(Mg2+)=c(Cu2+)=0.1mol·L-1时,Mg2+、Cu2+开始沉淀至沉淀完全的pH范围分别为__。已知:Ksp[Mg(OH)2]=10-9、Ksp[Cu(OH)2]=10-15,当c(Mg2+)≤1×10-5mol·L-1时视为沉淀完全。
(2)选择调控值
铝灰的回收利用方法很多,现用含有Al2O3、SiO2和少量FeO·xFe2O3的铝灰制备Al2(SO4)3·18H2O,工艺流程如下:
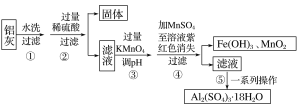
已知步骤③中所得溶液生成氢氧化物沉淀的pH如表所示:
Al(OH)3 | Fe(OH)2 | Fe(OH)3 | |
开始沉淀时的pH | 3.4 | 6.3 | 1.5 |
完全沉淀时的pH | 4.7 | 8.3 | 2.8 |
在该浓度下除去铁的化合物,调节pH的最大范围为___。
(3)如何调控
接问题(2),步骤③中调pH时最佳试剂为___。
(4)突破应用
为分析某铜合金的成分,用酸将其完全溶解后,用NaOH溶液调节pH,当pH=3.4时开始出现沉淀,分别在pH为7.0、8.0时过滤沉淀。
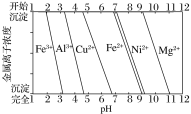
结合题图信息推断该合金中除铜外一定含有__。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知X、Y、Z都是短周期的元素,它们的原子序数依次递增,X原子的电子层数与它的核外电子总数相同,而Z原子的最外层电子数是次外层的三倍,Y和Z可以形成两种以上气态化合物,则:
(1)X是______,Y是______,Z是______(填元素符号)
(2)由Y和Z组成,且Y和Z的质量比为7∶20的化合物的化学式(分子式)是______.
(3)由X、Y、Z中的两种元素组成,且与![]() 分子具有相同电子数的两种离子是______和______
分子具有相同电子数的两种离子是______和______
(4)X、Y、Z可以形成一种盐,此盐中X、Y、Z元素的原子的个数比为4∶2∶3,该盐的化学式(分子式)是______
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】工业上冶炼锡的第一步反应原理为2SnO2 + 3C![]() 2Sn + aM↑+ CO2↑,则下列说法中错误的是( )
2Sn + aM↑+ CO2↑,则下列说法中错误的是( )
A. 反应中SnO2被还原 B. a的值为3
C. 反应后有两种氧化产物 D. 每生成1 mol CO2转移电子8 mol
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com