
【题目】选修3——物质结构与性质
已知X、Y、Z、R、Q为周期表中原子序数依次增大的前36号元素,相关信息如下:
X元素是宇宙中最丰富的元素 |
Y元素基态原子的核外p电子数比s电子数少1 |
Z元素被誉为“太空金属”,也有“生物金属”之称,其基态原子次外层有2个未成对电子 |
R元素在元素周期表的第十一列 |
Q元素在周期表里与R元素在同一个分区 |
请回答下列问题:
(1)YX3中心原子的杂化轨道类型是 ,离子化合物YX5的电子式是 。
(2)CO与Y2属于等电子体,1 个CO分子中含有的π键数目是 个。
(3)工业上利用ZO2和碳酸钡在熔融状态下制取化合物A(A可看做一种含氧酸盐),A晶体的晶胞为正方体(如图1)。
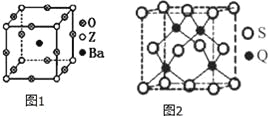
①制备A的化学反应方程式是 ;
②在A晶体中,Z的配位数为 ;
(4)R2+离子的外围电子层电子排布式为 。R2O的熔点比R2S的 (填“高”或“低”)。
(5)Q元素和硫(S)元素能够形成化合物B,B晶体的晶胞为正方体(如图2),若晶胞棱长为5.4×10-8cm,则晶胞密度为 gcm﹣3(列式并计算)。
【答案】(1)sp3; ;(2)2;
;(2)2;
(3)①;TiO2+BaCO3═BaTiO3+CO2↑;②6;(4)3d9;高;
(5)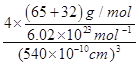 =4.1;
=4.1;
【解析】试题分析:已知X、Y、Z、R、Q为周期表中原子序数依次增大的前36号元素,X元素是宇宙中最丰富的元素,则X为H元素;Y元素原子的核外p轨道电子数比s轨道电子数少1,原子核外电子排布为1s22s22p3,则Y为N元素;Z元素被誉为“太空金属”,也有“生物金属”之称,其基态原子次外层有2个未成对电子,则Z为Ti元素;R元素在元素周期表的第十一列,属于第IB族,在第四周期,所以R为Cu;Q元素在周期表里与R元素在同一个分区,则Q为Zn元素。
(1)NH3中N原子形成3个键,含有1对孤电子对,杂化轨道数目为4,N原子杂化类型为sp3,NH5属于离子化合物,由铵根离子与氢负离子构成,电子式为 ;故答案为:sp3;
;故答案为:sp3; ;
;
(2)CO与N2互为等电子体,二者结构相似,所以CO分子结构式为C≡O,则1 个CO分子中含有的π键数目是2,故答案为:2;
(3)①可知晶胞中Ba原子数目为1,O原子数目为12×![]() =3、Ti原子数目为8×
=3、Ti原子数目为8×![]() =,故A为BaTiO3,反应还生成二氧化碳,反应方程式为:TiO2+BaCO3═BaTiO3+CO2↑,故答案为:TiO2+BaCO3═BaTiO3+CO2↑;
=,故A为BaTiO3,反应还生成二氧化碳,反应方程式为:TiO2+BaCO3═BaTiO3+CO2↑,故答案为:TiO2+BaCO3═BaTiO3+CO2↑;
②由BaTiO3晶胞可知,每个Ti4+周围有6个O2-,所以Ti4+的氧配位数为为6,故答案为:6;
③在BaTiO3晶体中,若将Ti4+置于立方体的体心,Ba2+置于立方体的顶点,则O2-只能处于立方体的面心,故答案为:面心;
(4)R为Cu,其原子核外电子排布式为1s22s22p63s23p63d104s1,则Cu2+离子的外围电子层电子排布式为3d9;离子电荷相同,氧离子半径小于硫离子半径,所以Cu2O的熔点比Cu2S的高;故答案为:3d9;高;
(5)晶胞中S原子数目为8×![]() +6×
+6×![]() =4,Zn原子位于晶胞内部,共4个,则晶胞质量为4×(65+32)g/mol÷6.02×1023mol-1),晶胞的体积为(540.0×10-10cm)3,则密度为ρ=
=4,Zn原子位于晶胞内部,共4个,则晶胞质量为4×(65+32)g/mol÷6.02×1023mol-1),晶胞的体积为(540.0×10-10cm)3,则密度为ρ=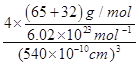 =4.1gcm-3;故答案为:
=4.1gcm-3;故答案为: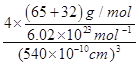 =4.1。
=4.1。


 步步高达标卷系列答案
步步高达标卷系列答案科目:高中化学 来源: 题型:
【题目】下列实验中均需要的仪器是( )
①配制一定物质的量浓度的溶液 ②PH试纸的使用 ③过滤 ④蒸发
A. 试管 B. 胶头滴管
C. 玻璃棒 D. 漏斗
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】NA代表阿伏伽德罗常数的值,下列叙述正确的是
A.1 L 1 mol/L FeBr2溶液与1 mol氯气反应时转移的电子数为3NA
B.0.5 mol/L硫酸钠溶液中含有溶质离子总数为1.5NA
C.1 mol硫酸氢钠固体中含阳离子总数NA
D.28 g由乙烯和聚乙烯组成的混合气体中含有碳碳双键数为NA
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在某学生的化学实验报告中有如下记录其中实验数据合理的( )
A. 用100 mL量筒量取5.26 mL稀硫酸溶液
B. 用托盘天平称取11.7 g CuO粉末
C. 用广泛pH试纸测得溶液的pH为3.5
D. 温度计上显示的室温读数为25.68oC
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】从银铜合金废料中回收银并制备铜化工产品的工艺如下:
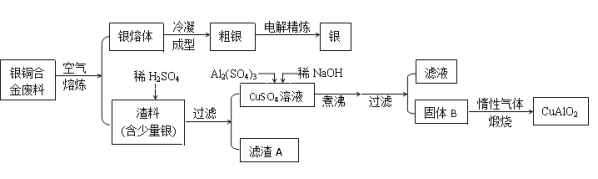
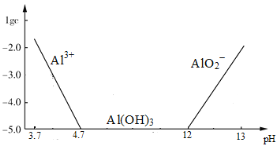
已知:①铝元素在溶液中的存在形态与溶液pH的关系如图所示。
②室温时,Cu(OH)2的溶度积Ksp=2.0×10-20,当溶液中某种离子浓度小于1.0×10-5mol/L时,认为该离子沉淀完全,![]() 。
。
③Al(OH)3和Cu(OH)2开始分解的温度分别为450℃和80℃。
请回答下列问题:
(1)电解精炼银时,粗银做 极(填“阴”或“阳”),电解质选用________溶液,阴极电极反应为 。
(2)在生成固体B的过程中,需控制NaOH的加入量,使溶液的pH范围在 ,若控制不当,使NaOH过量可能会引起的反应的离子方程式为 。
(3) 煅烧过程中发生多步反应,写出最终生成CuAlO2的反应的化学方程式: 。
(4)若银铜合金中铜的质量分数为64%,理论上1.0 kg废料中的铜可完全转化为CuAlO2,至少需要1.0 mol·L-1的Al2(SO4)3溶液 L。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】一定条件下,溶液的酸碱性对TiO2光催化染料R降解反应的影响如图所示。下列判断正确的是
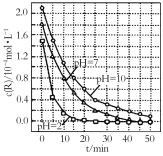
A.R的起始浓度越小,降解速率越大
B.在0~50 min之间,pH=2和pH=7时R的降解百分率相等
C.溶液酸性越强,R的降解速率越小
D.在20~25 min之间,pH=10时R的平均降解速率为0.04 mol·L-1·min-1
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】Ⅰ.对于混合物的分离或提纯,常采用的方法有:①过滤、②蒸发、③蒸馏、④萃取、⑤加热分解等。下列各组混和物的分离或提纯应采用什么方法?(填序号)
(1)提取碘水中的碘 ___________(2)除去食盐溶液中的水 ___________
(3)淡化海水 ___ ______ (4)KCl中含有KClO3 。
Ⅱ.根据以下装置图,回答下列问题:

写出仪器名称 ② ③ ;仪器①~④中,使用时必须检查是否漏水的有 (填序号)。
Ⅲ.某课外活动小组设计下列实验装置,验证“二氧化碳与水接触时才能和过氧化钠反应”。
(1)过氧化钠与水反应的化学方程式是 。
(2)装置Ⅰ是制备纯净的 ,则仪器①和②中最适宜的试剂组合是________(填字母)
a.稀盐酸 b.稀硫酸 c.小苏打 d.石灰石
(3)实验时,应先打开弹簧夹K2,关闭K1,观察到预期现象后,打开K1 ,再关闭K2。
(4)实验过程中将带火星的木条置于a口,观察到带火星的木条始终不复燃。
①为观察到最终木条复燃,甲建议在Ⅲ后安装一个盛有碱石灰的干燥管,目的是 ;
②乙认为即使采纳甲的建议且最终观察到木条复燃,也不能证明CO2参与了反应,原因是 。
(5)为进一步达到实验目的,应补充的实验是:取最终反应后Ⅲ中所得固体, 。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】短周期元素W、X、Y、Z的原子序数依次增加,m、p、r是由这些元素组成的二元化合物,n是元素Z的单质,通常为黄绿色气体,q的水溶液具有漂白性,0.01mol/L r溶液的pH为2,p是甲烷,上述物质的转化关系如图所示,下列说法正确的是
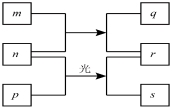
A.X的最高价氧化物对应的水化物为弱酸
B.元素的非金属性Z>X>Y
C.Y的氢化物常温常压下为气态
D.原子半径的大小W<X<Y
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列化学反应的离子方程式正确的是
A.向沸水中滴加FeCl3溶液制备Fe(OH)3胶体:Fe3++3H2O![]() Fe(OH)3↓+3H+
Fe(OH)3↓+3H+
B.往FeCl3溶液中加入Cu粉:2Fe3++Cu=2Fe2++Cu2+
C.碳酸钠溶液与石灰乳的反应:CO32-+Ca2+=CaCO3↓
D.氢氧化钡溶液与稀硫酸反应:Ba2++SO42-+H++OH-=BaSO4↓+H2O
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com