
【题目】某化学兴趣小组取部分变质的Ca(OH)2(含杂质CaCO3)样品4.0g投入200.0g水中,充分搅拌,通入足量CO2,溶液质量与反应的CO2质量的关系如图所示.则:
(1)以Ca(OH)2全部转化为CaCO3时消耗的CO2质量为_____g;
(2)4.0g样品中杂质CaCO3的质量为______________?(写出计算过程)
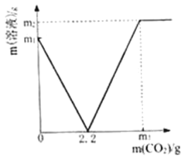
(3)通入m3gCO2时,溶液中生成物的溶质的质量分数为_____(精确到0.1%).若所取样品中的Ca(OH)2没有完全溶于水,对最后的计算结果_____(填“有”、“没有”)影响.原因是_____.
【答案】2.2 0.3g 4.2% 没有 未溶解的氢氧化钙也能与二氧化碳生成碳酸钙.
【解析】
向样品溶液中通入二氧化碳,氢氧化钙与二氧化碳反应生成碳酸钙,溶液质量减少;继续通入二氧化碳,碳酸钙与水、二氧化碳反应生成碳酸氢钙,溶液质量增加。
(1)由图可知,溶液质量为0时,氢氧化钙全部转化为碳酸钙,此时消耗的二氧化碳的质量为2.2g。
(2)设样品中氢氧化钙的质量为x,根据反应方程式Ca(OH)2+CO2=CaCO3+H2O,氢氧化钙与二氧化碳按质量比74:44进行反应,则![]() ,解得x=3.7g,则碳酸钙的质量为4.0g-3.7g=0.3g。
,解得x=3.7g,则碳酸钙的质量为4.0g-3.7g=0.3g。
(3)继续通入二氧化碳,溶液中发生如下反应CaCO3+CO2+H2O=Ca(HCO3)2,设氢氧化钙反应生成的碳酸钙的质量为y,则反应二氧化碳与生成的碳酸钙按质量比为44:100, ![]() ,解得y=5g;设生成碳酸氢钙质量为z,根据反应CaCO3+CO2+H2O=Ca(HCO3)2,反应碳酸钙与生成碳酸氢钙质量比为100:162,则
,解得y=5g;设生成碳酸氢钙质量为z,根据反应CaCO3+CO2+H2O=Ca(HCO3)2,反应碳酸钙与生成碳酸氢钙质量比为100:162,则![]() ,解得z=8.586g,溶质质量分数为
,解得z=8.586g,溶质质量分数为![]() ;若所取样品中的氢氧化钙没有完全溶于水,对最后的计算结果没有影响,因为未溶于水的氢氧化钙固体也能与过量二氧化碳反应生成碳酸钙,故样品最终全部转化为碳酸氢钙。
;若所取样品中的氢氧化钙没有完全溶于水,对最后的计算结果没有影响,因为未溶于水的氢氧化钙固体也能与过量二氧化碳反应生成碳酸钙,故样品最终全部转化为碳酸氢钙。


科目:高中化学 来源: 题型:
【题目】下列各组物质中,满足如图物质一步转化关系的选项是( )
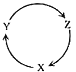
选项 | X | Y | Z |
A | Na | NaOH | NaHCO3 |
B | S | SO2 | SO3 |
C | C | CO | CO2 |
D | Si | SiO2 | H2SiO3 |
A.AB.BC.CD.D
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】喷泉是一种常见的自然现象,其产生的原因是存在压强差。制取氨气并完成喷泉实验(图中夹持装置均已略去)。
①写出实验室制取氨气的化学方程式:______________。
②收集氨气应使用_________法,要得到干燥的氨气可选用_________做干燥剂。
③用如图一装置进行喷泉实验,上部烧瓶已装满干燥氨气,引发水上喷的操作是___________,该实验的原理是____________________。
④如果只提供如图二的装置,请说明引发喷泉的方法__________________________。
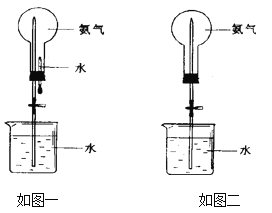
查看答案和解析>>
科目:高中化学 来源: 题型:
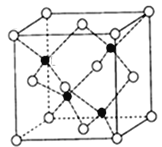
【题目】镓(Ga)、锗( Ge)、砷(As)、硒(Se)均为第四周期的元素,它们在高科技尖端科学特别是信息领域有着广泛的用途。试回答下列问题:
(1)基态锗原子的价电子排布图为_____。
(2)沸点:NH3_______AsH3(填“>”、“<”或“=”),原因是____________。
(3)H2SeO4和H2SeO3是硒的两种含氧酸,请根据结构与性质的关系,解释H2SeO4比H2SeO3 酸性强的原因________。
(4)砷化镓可由(CH3)3Ga和AsH3在700℃下反应制得,同时得到一种最简单的有机物,写出该反应的方程式为_____;砷化镓的晶胞结构如下图所示,其晶胞边长为a pm(1pm=10-12m),则每立方厘米该晶体中所含砷元素的质量为_____g(用NA表示阿伏加德罗常数的值)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】有机物M只含C、H、O三种元素,其分子模型如下图所示(图中球与球之间的连线代表化学键,如单键、双键等)。
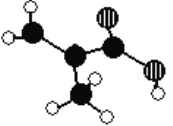
(1)有机物M的结构简式为__________________________,用1H核磁共振谱可以证明该化合物的核磁共振氢谱中有________种吸收峰。
(2)下列物质中,与有机物M互为同分异构体的是___(填序号),与有机物M互为同系物的是_______(填序号)。
①CH3CH=CHCOOH ②CH2=CHCOOCH3 ③CH3CH2CH=CHCOOH ④CH3CH(CH3)COOH
(3)M分子中最多有_________个碳原子共面,其中碳原子的杂化类型有___________。
(4)由M分子聚合可得到只含一种官能团的高分子化合物,写出该反应方程式____________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】2017年5月18日,中国在南海成功试采可燃冰,它将推动世界能源利用格局的改变.可燃冰是在高压低温环境条件下,水分子笼中装有甲烷分子而成的“冰块”,可直接点燃.己知某种可燃冰的化学式为:CH48H2O.请回答:
(1)这种可燃冰中含有_____种元素:原子个数比:C:H:O=_____;
(2)这种可燃冰中甲烷的质量分数为_____%;936g(约1升)该可燃冰常温下可释放出_____升甲烷(常温下甲烷密度为0.72g/L).
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下表为元素周期表的一部分,用化学用语回答下列问题:
主族 周期 | I | II | III | IV | V | VI | VII |
一 | ① | ||||||
二 | ② | ③ | ④ | ||||
三 | ⑤ | ⑥ | ⑦ | ⑧ | ⑨ | ⑩ |
(1)⑧的原子结构示意图为________________。
(2)④和⑧在周期表中的位置分别是________________;________________。
(3)②和③气态氢化物稳定性的大小顺序:________________(填化学式)。
(4)③⑧⑩的最高价含氧酸的酸性最强的是________________(填化学式)。
(5)③的气态氢化物与③的最高价氧化物对应的水化物反应生成的盐是__(填化学式),属于___(填“共价化合物”或“离子化合物”)。
(6)①④⑩三种元素的原子能形成原子数目比为1∶1∶1的共价化合物,它的电子式为_____。
(7)欲比较④和⑨两种元素的非金属性强弱,可以作为验证的证据是_____(填字母)。
A.比较这两种元素单质的沸点
B.比较这两种元素单质与氢气化合的难
C.比较这两种元素的最高价氧化物对应水化物的酸碱性
D.比较这两种元素单质与酸或碱反应的难易性
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】亚硝酰氯(NOCl,熔点:-64.5℃,沸点:-5.5℃)是一种黄色气体,遇水易水解。可用于合成清洁剂、触媒剂及中间体等。实验室可由氯气与一氧化氮在常温常压下合成。
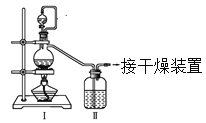
(1)甲组的同学拟制备原料气NO和Cl2,制备装置如下图所示:
为制备纯净干燥的气体,下表中缺少的药品是:
装置Ⅰ | 装置Ⅱ | ||
烧瓶中 | 分液漏斗中 | ||
制备纯净Cl2 | MnO2 | ①________ | ②________ |
制备纯净NO | Cu | ③________ | ④________ |
(2)乙组同学利用甲组制得的NO和Cl2制备NOCl,装置如图所示:
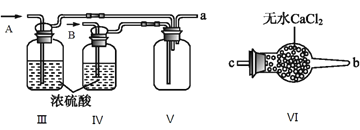
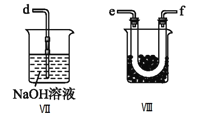
①为了使气体充分反应,从A处进入的气体是____________(填Cl2或NO)。
②装置连接顺序为a→_______________________(按气流自左向右方向,用小写字母表示)。
③装置Ⅲ、Ⅳ除可干燥NO、Cl2外,另一个作用是________________________。
④装置Ⅷ的烧杯中盛放的试剂是_____________________(填编号①水②冰水③冰盐水)
⑤装置Ⅶ中吸收尾气时,NOCl发生反应的化学方程式为___________________________________。
(3)丙组同学查阅资料,查得王水是浓硝酸与浓盐酸的混酸,一定条件下混酸可生成亚硝酰氯和氯气,该反应的化学方程式为________________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】向容积为2L的密闭容器中充入2molA气体和1molB气体,在一定条件下发生如下反应:2A(g)+B(g)![]() 3C(g);经2s后达到平衡,测得C气体的浓度为0.6mol·L-1。下列说法中正确的是( )
3C(g);经2s后达到平衡,测得C气体的浓度为0.6mol·L-1。下列说法中正确的是( )
A.用物质A表示该反应的平均速率为0.2mol·L-1·s-1
B.用物质B表示该反应的平均反应速率为0.2mol·L-1·s-1
C.平衡时物质A与B的转化率相等
D.平衡时物质B的浓度为0.2mol·L-1
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com