
����Ŀ���±�ΪԪ�����ڱ���һ���֣��û�ѧ����ش��������⣺
���� ���� | I | II | III | IV | V | VI | VII |
һ | �� | ||||||
�� | �� | �� | �� | ||||
�� | �� | �� | �� | �� | �� | �� |
(1)���ԭ�ӽṹʾ��ͼΪ________________��
(2)�ܺ͢������ڱ��е�λ�÷ֱ���________________��________________��
(3)�ں͢���̬�⻯���ȶ��ԵĴ�С˳��________________(�ѧʽ)��
(4)�ۢ�����ۺ������������ǿ����________________(�ѧʽ)��
(5)�۵���̬�⻯����۵�����������Ӧ��ˮ���ﷴӦ���ɵ�����__(�ѧʽ)������___(�������ۻ��������������ӻ�������)��
(6)�٢ܢ�����Ԫ�ص�ԭ�����γ�ԭ����Ŀ��Ϊ1��1��1�Ĺ��ۻ�������ĵ���ʽΪ_____��
(7)���ȽϢܺ͢�����Ԫ�صķǽ�����ǿ����������Ϊ��֤��֤����_____(����ĸ)��
A���Ƚ�������Ԫ�ص��ʵķе�
B���Ƚ�������Ԫ�ص������������ϵ���
C���Ƚ�������Ԫ�ص�����������Ӧˮ����������
D���Ƚ�������Ԫ�ص��������Ӧ��������
���𰸡�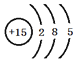 �ڶ����ڣ���VIA�� �������ڣ���VA�� NH3>CH4 HClO4 NH4NO3 ���ӻ�����
�ڶ����ڣ���VIA�� �������ڣ���VA�� NH3>CH4 HClO4 NH4NO3 ���ӻ����� ![]() B
B
��������
����Ԫ�������ڱ��е����λ�ÿ�֪�١���ֱ���H��C��N��O��Na��Mg��Al��P��S��Cl��
(1)��ΪPԪ�أ�ԭ�ӽṹʾ��ͼΪ�� ��
��
(2)��ΪOԪ�أ������ڱ��е�λ���ǵڶ����ڣ���VIA�壬��ΪPԪ�أ������ڱ��е�λ���ǵ������ڣ���VA�壻
(3)�ں͢�����ͬ���ڣ��������ҷǽ�������ǿ������̬�⻯���ȶ��Դ�С˳����NH3��CH4��
(4)�ۡ��ࡢ��ķǽ�������ǿ����Cl������ۺ������������ǿ����HClO4��
(5) �۵���̬�⻯���ǰ������۵�����������Ӧ��ˮ���������ᣬ���߷�Ӧ����ʽNH3+HNO3=NH4NO3����������Σ��������ӻ����
(6)�١��ܡ�������Ԫ�ص�ԭ�����γ�ԭ����Ŀ��Ϊ1:1:1�Ĺ��ۻ�������HClO������ʽΪ![]() ��
��
(7)A��Ԫ�ص��ʵķе㲻�������ȽϷǽ�����ǿ����A����
B��Ԫ�ص�������������Խ���ף��ǽ�����Խǿ��B��ȷ��
C����Ԫ��û�����������ˮ���C����
D��Ԫ�ص��������Ӧ�������ԣ����������ȽϷǽ�����ǿ����D����
��ѡB��


 ѧ���������ν��Ͼ���ѧ������ϵ�д�
ѧ���������ν��Ͼ���ѧ������ϵ�д� Happy holiday���ּ��������ҵ�㶫���������ϵ�д�
Happy holiday���ּ��������ҵ�㶫���������ϵ�д� ���������������Բ��������ϵ�д�
���������������Բ��������ϵ�д�
| �꼶 | ���пγ� | �꼶 | ���пγ� |
| ��һ | ��һ��ѿγ��Ƽ��� | ��һ | ��һ��ѿγ��Ƽ��� |
| �߶� | �߶���ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
| ���� | ������ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
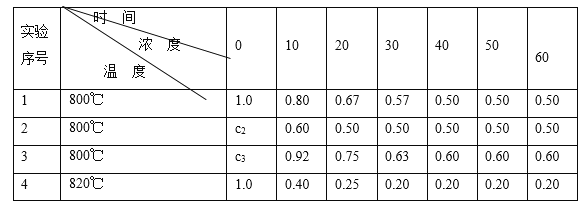
����Ŀ��ij��ѧ��Ӧ2A ![]() B��D�����ֲ�ͬ�����½��У�B��D��ʼŨ��Ϊ0����Ӧ��A��Ũ�ȣ�mol/L���淴Ӧʱ�䣨min���ı仯������±���
B��D�����ֲ�ͬ�����½��У�B��D��ʼŨ��Ϊ0����Ӧ��A��Ũ�ȣ�mol/L���淴Ӧʱ�䣨min���ı仯������±���
�����������ݣ����������գ�
��1����ʵ��1����Ӧ��10��20����ʱ����ƽ������Ϊ_____mol/��L��min����
��2����ʵ��2��A�ij�ʼŨ��c2��____________mol/L����Ӧ��20���Ӿʹﵽƽ�⣬���Ʋ�ʵ��2�л�������������___________��
��3����ʵ��3�ķ�Ӧ����Ϊv3��ʵ��1�ķ�Ӧ����Ϊv1����v3_______v1�����������������c3_______1.0 mol/L���������������
��4���Ƚ�ʵ��4��ʵ��1�����Ʋ�÷�Ӧ��____��Ӧ��ѡ�����ȡ����ȣ��������� __________
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ����һ�������£�N2O�ֽ�IJ���ʵ���������£� ��
��Ӧʱ��/min | 0 | 10 | 20 | 30 | 40 | 50 | 60 | 70 | 80 | 90 | 100 |
c��N2O��/molL-1 | 0.100 | 0.090 | 0.080 | 0.070 | 0.060 | 0.050 | 0.040 | 0.030 | 0.020 | 0.010 | 0.000 |
��ͼ����ȷ��ʾ�÷�Ӧ�й��������仯���ɵ��ǣ� ��
��ע��ͼ�а�˥��ָ��һŨ��N2O����һ��ʱ�������Ӧʱ�䣬c1��c2����ʾN2O��ʼŨ����c1��c2��
A��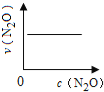 B��
B��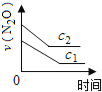 C��
C��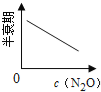 D��
D��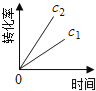
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��ij��ѧ��ȤС��ȡ���ֱ��ʵ�Ca��OH��2��������CaCO3����Ʒ4.0gͶ��200.0gˮ�У���ֽ��裬ͨ������CO2����Һ�����뷴Ӧ��CO2�����Ĺ�ϵ��ͼ��ʾ����
(1)��Ca��OH��2ȫ��ת��ΪCaCO3ʱ���ĵ�CO2����Ϊ_____g��
(2)4.0g��Ʒ������CaCO3������Ϊ______________����д��������̣�
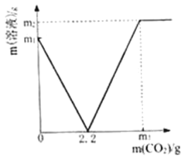
(3)ͨ��m3gCO2ʱ����Һ������������ʵ���������Ϊ_____����ȷ��0.1%��������ȡ��Ʒ�е�Ca��OH��2û����ȫ����ˮ�������ļ�����_____��������������û������Ӱ�죮ԭ����_____��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ������18ͼ��Ϊ�����ʵ��ܽ�����ߡ���ش�:
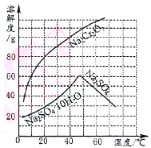
(1)50��ʱ��Na2Cr2O7���ܽ��Ϊ________g��60��ʱ�ܽ�ȣ�Na2Cr2O7__________Na2SO4(����<������=������>��)��
(2)��50��ʱ����210gNa2Cr2O7������Һ���µ�10��ʱ������Na2Cr2O7______________g (���費���ᾧˮ)��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ������ָ����Ӧ�����ӷ���ʽ��ȷ����(����)
A. ��������ˮ��Cl2+H2O2H++Cl��+ClO��
B. ��FeSO4��Һ�м���H2SO4�ữ��KMnO4��Һ��5Fe2++MnO4��+8H+�T5Fe3++Mn2++4H2O
C. ����������ʯ��ˮ�м���������NaHCO3��Һ��Ca2++OH��+HCO3���TCaCO3��+H2O
D. ��ͭ���缫���NaCl��Һ��2Cl��+2H2O![]() H2��+Cl2��+2OH��
H2��+Cl2��+2OH��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ���������ӷ���ʽ��ȷ����(����)
��������ˮ��Ӧ��Cl2��H2O===2H����Cl����ClO��
������������������Һ��Ӧ��Cl2��2OH��===Cl����ClO����H2O
��Ũ������������̹��ȣ�MnO2��4HCl![]() Mn2����2Cl����Cl2����2H2O
Mn2����2Cl����Cl2����2H2O
��Ư����Һ��ͨ�������Ķ�����̼���壺Ca2����2ClO����H2O��CO2===CaCO3����2HClO
A.�٢�B.�ڢ�C.�ڢ�D.�٢�
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ�����ڷ�Ӧ![]() ���ݻ�Ϊ10L���ܱ������н��С���ʼʱ
���ݻ�Ϊ10L���ܱ������н��С���ʼʱ![]() ��
��![]() ��Ϊ0.20mol����Ӧ�ڲ�ͬ�����½��У���Ӧ��ϵ��ѹǿ��ʱ��ı仯��ͼ��ʾ������˵������ȷ���ǣ� ��
��Ϊ0.20mol����Ӧ�ڲ�ͬ�����½��У���Ӧ��ϵ��ѹǿ��ʱ��ı仯��ͼ��ʾ������˵������ȷ���ǣ� ��
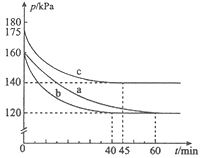
A. ʵ��c�����£��ӷ�Ӧ��ʼ���ﵽƽ��ʱ![]()
B. ʵ��a�����£���Ũ�ȱ�ʾ��ƽ�ⳣ��Ϊ100
C. �÷�Ӧ��![]()
D. �Ƚ�ʵ��a��c���ж������¶ȷ�Ӧ���ʼӿ�
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ����֪A������ʯ�͵���Ҫ�л�����ԭ�ϣ�E�Ǿ��й���ζ���л��F��һ�ָ߾�����Ƴɶ��ְ�װ���ϡ�������ͼת����ϵ������и��⣺
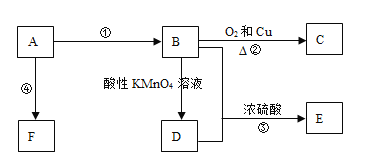
��1��A�ķ���ʽ��__��C��������__��F�Ľṹ��ʽ��__��
��2��D�����еĹ�����������__�������һ����ʵ������֤D���ʴ��ڸù����ţ��䷽����__��
��3��д����Ӧ�ڵĻ�ѧ����ʽ��ָ���۵ķ�Ӧ���ͣ�
��Ӧ�ڣ�__����Ӧ��������__��Ӧ��
�鿴�𰸺ͽ���>>
����ѧУ��ѡ - ��ϰ���б� - �����б�
����ʡ������Υ���Ͳ�����Ϣ�ٱ�ƽ̨ | �����к���Ϣ�ٱ�ר�� | ����թƭ�ٱ�ר�� | ����ʷ���������к���Ϣ�ٱ�ר�� | ������Ȩ�ٱ�ר��
Υ���Ͳ�����Ϣ�ٱ��绰��027-86699610 �ٱ����䣺58377363@163.com