
【题目】短周期主族元素M、X、Y、Z的原子序数依次增大,湿润的红色石蕊试纸遇M的气态氢化物变蓝色。含X、Y和Z三种元素的化合物R有如下转化关系(已知酸性强弱:HClO3>HNO3)。下列说法正确的是
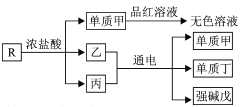
A.简单离子半径:Y>Z>M>X
B.简单气态氢化物的热稳定性:M>X
C.加热单质甲与品红溶液反应所得的“无色溶液”,可变成红色溶液
D.常温下,向蒸馏水中加入少量R,水的电离程度可能增大
【答案】D
【解析】
在短周期主族元素中,可以形成强碱的是Na元素,所以强碱戊为NaOH。能使品红溶液褪色的气体可能是SO2、Cl2,单质只有Cl2。 电解氯化钠水溶液生成氢氧化钠、氢气和氯气,故R可能是NaClO。M的气态氢化物使湿润的红色石蕊试纸变蓝色,说明M为氮元素。综上所述,M为氮元素,X为氧元素,Y为钠元素,Z为氯元素。
A.X为氧元素,Y为钠元素,Z为氯元素,M为氮元素,Cl-、N3-、O2-、Na+的半径依次减小,故A错误;
B.X为氧元素,M为氮元素,非金属性越强,简单气态氢化物的稳定性越强,非金属性:O>N,H2O的热稳定性比NH3强,故B错误;
C.若气体甲为氯气,则加热“无色溶液”,由于次氯酸漂白后较稳定,溶液不变色,故C错误;
D.NaClO属于强碱弱酸盐,能够发生水解,可促进水的电离,故D正确;
答案选D。


科目:高中化学 来源: 题型:
【题目】N2O、NO和NO2等氮氧化物是空气污染物,含有氮氧化物的尾气需处理后才能排放。
(1)N2O的处理。N2O是硝酸生产中氨催化氧化的副产物,用特种催化剂能使N2O分解。NH3与O2在加热和催化剂作用下生成N2O的化学方程式为________。
(2)NO和NO2的处理。已除去N2O的硝酸尾气可用NaOH溶液吸收,主要反应为
NO+NO2+2OH![]() 2
2![]() +H2O
+H2O
2NO2+2OH![]()
![]() +
+![]() +H2O
+H2O
①下列措施能提高尾气中NO和NO2去除率的有________(填字母)。
A.加快通入尾气的速率
B.采用气、液逆流的方式吸收尾气
C.吸收尾气过程中定期补加适量NaOH溶液
②吸收后的溶液经浓缩、结晶、过滤,得到NaNO2晶体,该晶体中的主要杂质是________(填化学式);吸收后排放的尾气中含量较高的氮氧化物是________(填化学式)。
(3)NO的氧化吸收。用NaClO溶液吸收硝酸尾气,可提高尾气中NO的去除率。其他条件相同,NO转化为![]() 的转化率随NaClO溶液初始pH(用稀盐酸调节)的变化如图所示。
的转化率随NaClO溶液初始pH(用稀盐酸调节)的变化如图所示。
①在酸性NaClO溶液中,HClO氧化NO生成Cl和![]() ,其离子方程式为________。
,其离子方程式为________。
②NaClO溶液的初始pH越小,NO转化率越高。其原因是________。

查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】将11.2 g铁粉投入到盛有100 mL 、3 mol·L-1稀硫酸的烧杯中,4 min时铁粉刚好溶解(溶解前后溶液体积变化忽略不计),下列表示这个反应的速率正确的是
A.v(Fe)=0.5 mol/(L·min)B.v(H2SO4)=1.5 mol/(L·min)
C.v(H2SO4)=0.5 mol/(L·min)D.v(FeSO4)=1 mol/(L·min)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】取体积均为1 L的四组X的溶液进行实验(X受热发生分解反应),在不同温度下测得X的物质的量(mol)随时间的变化如下表所示。下列说法不正确的是
| 0 min | 10 min | 20 min | 30 min | 40 min | 50 min | 60 min | |
① | 10°C | 1.1 | 0.90 | 0.80 | 0.73 | 0.68 | 0.65 | 0.65 |
② | 10°C | a | 0.70 | 0.65 | 0.65 | 0.65 | 0.65 | 0.65 |
③ | 25°C | 1.0 | 0.70 | 0.50 | 0.35 | 0.25 | 0.20 | 0.20 |
④ | 30°C | 2.0 | 1.4 | 0.90 | 0.50 | 0.20 | 0.13 | 0.13 |
A.在0~10 min内,实验③④中X的转化率相同
B.实验②中改变的条件可能是加入催化剂
C.在10~20 min内,实验①中X的平均分解速率为0.01 mol L-1min-1
D.对比实验①和④,能说明X的反应速率随温度升高而增大
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】有机化合物甲、乙、丙的结构如图所示,下列说法正确的是
甲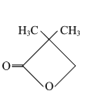 乙
乙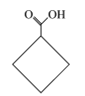 丙
丙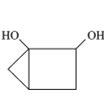
A.三种物质的分子式均为C5H8O2,互为同分异构体
B.甲、乙、丙分子中的所有环上的原子可能共平面
C.三种物质均可以发生氧化反应和加成反应
D.三种物质都能与氢氧化钠溶液发生反应
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某镁铝合金MgxAly(其中x、y为整数)是贮氢材料,可在通入氩气的条件下,将一定化学计量比的Al、Mg单质在一定温度下熔炼制得.为测定该合金的成分,称取一定质量的样品放入600mL稀硫酸中,样品全部溶解并产生气体.待反应完全后,向所得溶液中加入NaOH溶液,生成沉淀的物质的量与NaOH溶液的体积关系如图所示.完成下列问题:
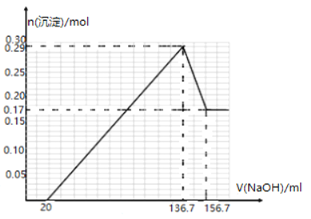
(1)熔炼制取镁铝合金(MgxAly)时通入氩气的目的是_____________。
(2)NaOH溶液的物质的量浓度为____________。
(3)该镁铝合金(MgxAly)的化学式为_____________。
(4)该合金在一定条件下吸氢的化学方程式为:MgxAly+xH2═xMgH2+yA1,得到的混合物在6.0mol·L-1HCl溶液中能完全释放出H2,1mol MgxAly完全吸氢后得到的混合物与上述盐酸完全反应,释放出H2的物质的量为__________________。
(5)将该镁铝合金置于NaOH溶液可以构成原电池,写出负极发生的反应_____________________。
(6)如图甲为甲醇燃料电池,乙池为铝制品表面“钝化”装置,两极分别为铝制品和石墨.M电极的材料是_________________。
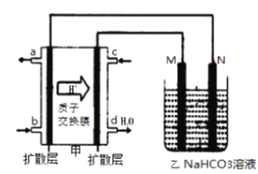
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】工业上利用电镀污泥(主要含有Fe2O3、CuO、Cr2O3及部分难溶性杂质)回收铜和铬等金属,回收流程如图所示:

已知部分物质沉淀的pH(如表)及CaSO4元的溶解度曲线(如图):
Fe3+ | Cu2+ | Cr3+ | |
开始沉淀 | 2.1 | 4.7 | 4.3 |
完全沉淀 | 3.2 | 6.7 | 5.6 |

(1)在浸出过程中除了生成Fe2(SO4)3、Cr2(SO4)3外,主要还有_____________(填化学式)。
(2)在除铁操作中,需要除去Fe3+和CaSO4,请完成相关操作:①加入石灰乳调节pH到______;
②将浊液加热到80℃,____________。
(3)写出还原步骤中加入NaHSO3生成Cu2O固体的离子方程式:_________,此步骤中加入NaHSO3得到Cu2O的产率为95%,若NaHSO3过量,除了浪费试剂外,还会出现的问题是______________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】石油是由多种碳氢化合物组成的混合物,石油精炼可以获得多种化工原料。

请根据上图回答下列问题:
(1)由原油获得汽油,分离的方法是__________________________。
(2)丙烯在一定条件下生成聚丙烯,这种高分子化合物的链节为____________________________。
(3)石油裂化是为了得到更多的汽油,裂化汽油可以使溴的四氯化碳溶液褪色,其原因是_______。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】运用有关概念判断下列叙述正确的是( )
A.1mol H2燃烧放出的热量为H2的燃烧热
B.Na2SO3和H2O2的反应为氧化还原反应
C.![]() 和
和![]() 互为同系物
互为同系物
D.BaSO4的水溶液不导电,故BaSO4是弱电解质
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com