
【题目】取体积均为1 L的四组X的溶液进行实验(X受热发生分解反应),在不同温度下测得X的物质的量(mol)随时间的变化如下表所示。下列说法不正确的是
| 0 min | 10 min | 20 min | 30 min | 40 min | 50 min | 60 min | |
① | 10°C | 1.1 | 0.90 | 0.80 | 0.73 | 0.68 | 0.65 | 0.65 |
② | 10°C | a | 0.70 | 0.65 | 0.65 | 0.65 | 0.65 | 0.65 |
③ | 25°C | 1.0 | 0.70 | 0.50 | 0.35 | 0.25 | 0.20 | 0.20 |
④ | 30°C | 2.0 | 1.4 | 0.90 | 0.50 | 0.20 | 0.13 | 0.13 |
A.在0~10 min内,实验③④中X的转化率相同
B.实验②中改变的条件可能是加入催化剂
C.在10~20 min内,实验①中X的平均分解速率为0.01 mol L-1min-1
D.对比实验①和④,能说明X的反应速率随温度升高而增大
【答案】D
【解析】
A.实验③④温度不同,起始量不同,X的![]() ;
;
B.分析表格可知①②,a为1.1,达到相同平衡状态下②达到平衡所需时间少;
C.在10~20min内,实验①中X减少了0.9mol-0.8mol=0.1mol,据此计算平均分解速率![]() ;
;
D.起始量和温度不同,不能直接得出X的反应速率随温度升高而增大。
A. 在010min内,实验③中X的转化率![]() ,在010min内,实验④中X的转化率
,在010min内,实验④中X的转化率![]() ,X的转化率相同,故A正确;
,X的转化率相同,故A正确;
B. 分析表格可知①②,a为1.1,达到相同平衡状态下②达到平衡所需时间少,所以改变的条件是加入了催化剂,故B正确;
C. 在1020min内,实验①中X减少了0.9mol0.8mol=0.1mol,据此计算平均分解速率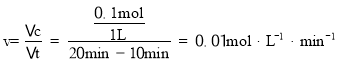 故C正确;
故C正确;
D. 温度不同,起始量不同,不能直接比较反应速率,应控制同一变量,故D错误;
故答案选:D。


科目:高中化学 来源: 题型:
【题目】某有机物是药物生产的中间体,其结构简式如图。下列有关叙述正确的是( )

A. 该有机物能与溴水发生加成反应
B. 该有机物与浓硫酸混合加热可发生消去反应
C. 1 mol 该有机物与足量NaOH溶液反应最多消耗3 mol NaOH
D. 该有机物经催化氧化后能发生银镜反应
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】我国科研人员提出了由CO2和CH4转化为高附加值产品CH3COOH的催化反应历程。该历程示意图如下。下列说法不正确的是
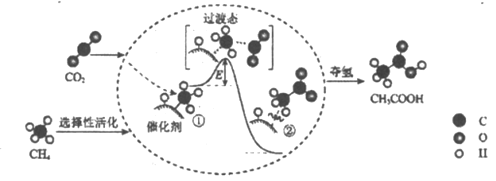
A.转化过程中发生了氧化还原反应
B.①→②放出能量并形成了C—C键
C.生成CH3COOH总反应的原子利用率为100%
D.该催化剂降低了反应活化能,反应物平衡转化率得到提高
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】氨气与适量氯气混合反应可生成NH4Cl(岩脑砂的主要成分)和一种无污染的气体。某学习小组利用下列装置模拟该反应,请回答相关问题。
A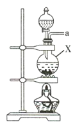 B
B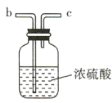
C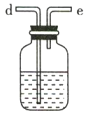 D
D
(1)该实验中所需的氯气是用浓盐酸与MnO2反应制取。装置A中仪器X的名称为 ________________ 。
(2)要得到干燥纯净的氯气,A、B、C装置中导管的连接顺序为a→ ________________ → ________________ → ________________ → ________________ 。
(3)利用D装置,将适量氨气与氯气充分混合,氨气应从__________ 通入,反应的化学方程式为 ___________;可能观察到的现象是________________。
(4)现取岩脑砂进行NH4Cl含量的测定。准确称取一定质量的岩脑砂,与足量的氧化铜混合,如图所示进行实验。已知:2NH4Cl+3CuO![]() 3Cu+N2↑+2HCl↑+3H2O
3Cu+N2↑+2HCl↑+3H2O
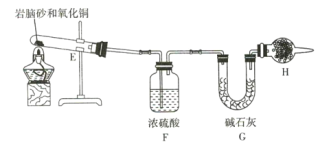
①为顺利完成有关物理量的测定,请完善下列表格。
测量时间点 | 反应前 | 反应后 |
测量内容 | ________________ | 当观察到 ________________ 现象时停止加热,冷却,称量H装置的总质量 |
②如果不用H装置,测出NH4Cl的含量将 _____ (填“偏高”“偏低”或“无影响”)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】N2O5在一定温度下可发生反应:2N2O5(g)![]() 4NO2(g)+O2(g) ΔH>0。T1温度时,向密闭容器中通入N2O5气体,部分实验数据见下表:
4NO2(g)+O2(g) ΔH>0。T1温度时,向密闭容器中通入N2O5气体,部分实验数据见下表:
时间/s | 0 | 500 | 1000 | 1500 |
c(N2O5)/(mol·L-1) | 5.00 | 3.52 | 2.50 | 2.50 |
下列说法正确的是( )
A.500s内NO2的生成速率为2.96×10-3mol/(L·s)
B.T1温度下该反应平衡时N2O5的转化率为29.6%
C.平衡后,其他条件不变,将容器体积变为原来的![]() ,则c(N2O5)<5.00mol/L
,则c(N2O5)<5.00mol/L
D.T1、T2温度下的平衡常数分别为K1、K2,若T1>T2,则K1>K2
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】邮票是国家邮政发行的一种邮资凭证,被誉为国家名片。新中国化学题材邮票展现了我国化学的发展和成就,是我国化学史不可或缺的重要文献。下列说法错误的是
A. 邮票中的人物是侯德榜。其研究出了联产纯碱与氯化铵化肥的制碱新工艺,创立了中国人自己的制碱工艺一侯氏制碱法
邮票中的人物是侯德榜。其研究出了联产纯碱与氯化铵化肥的制碱新工艺,创立了中国人自己的制碱工艺一侯氏制碱法
B. 邮票中的图是用橡胶生产的机动车轮胎。塑料、橡胶和纤维被称为三大合成材料,它们不断替代金属成为现代社会使用的重要材料
邮票中的图是用橡胶生产的机动车轮胎。塑料、橡胶和纤维被称为三大合成材料,它们不断替代金属成为现代社会使用的重要材料
C. 邮票中的图是显微镜视野下的结晶牛胰岛素。我国首次合成的人工牛胰岛素属于蛋白质
邮票中的图是显微镜视野下的结晶牛胰岛素。我国首次合成的人工牛胰岛素属于蛋白质
D. 邮票是纪念众志成城抗击非典的邮票。冠状病毒其外壳为蛋白质,用紫外线、苯酚溶液、高温可以杀死病毒
邮票是纪念众志成城抗击非典的邮票。冠状病毒其外壳为蛋白质,用紫外线、苯酚溶液、高温可以杀死病毒
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】短周期主族元素M、X、Y、Z的原子序数依次增大,湿润的红色石蕊试纸遇M的气态氢化物变蓝色。含X、Y和Z三种元素的化合物R有如下转化关系(已知酸性强弱:HClO3>HNO3)。下列说法正确的是
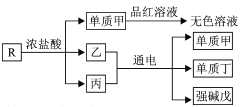
A.简单离子半径:Y>Z>M>X
B.简单气态氢化物的热稳定性:M>X
C.加热单质甲与品红溶液反应所得的“无色溶液”,可变成红色溶液
D.常温下,向蒸馏水中加入少量R,水的电离程度可能增大
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某温度下的反应为SO2(g)+![]() O2(g)
O2(g)![]() SO3(g) △H=-98 kJ·mol-1。开始时在100 L的密闭容器中加入4.0 mol SO2(g)和10.0 mol O2(g),当反应达到平衡时共放出热量196 kJ,此温度下,该反应的平衡常数为
SO3(g) △H=-98 kJ·mol-1。开始时在100 L的密闭容器中加入4.0 mol SO2(g)和10.0 mol O2(g),当反应达到平衡时共放出热量196 kJ,此温度下,该反应的平衡常数为
A.1B.3C.![]() D.
D.![]()
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列关于热化学反应的描述中正确的是
A.HCl和NaOH反应的中和热△//=-57.3kJ/mol,则H2SO4和Ca(OH)2反应的中和热△=2×(-57.3)kJ/mol
B.需要加热才能发生的反应一定是吸热反应
C.CO(g)的燃烧热是283.0kJ/mol,则2CO2(g)=2CO(g)+O2(g)反应的△H=+2×283.0kJ/mo1
D.1 mol甲烷燃烧生成气态水和二氧化碳所放出的热量是甲烷的燃烧热
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com