
【题目】氨气与适量氯气混合反应可生成NH4Cl(岩脑砂的主要成分)和一种无污染的气体。某学习小组利用下列装置模拟该反应,请回答相关问题。
A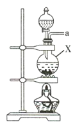 B
B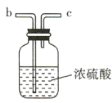
C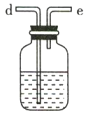 D
D
(1)该实验中所需的氯气是用浓盐酸与MnO2反应制取。装置A中仪器X的名称为 ________________ 。
(2)要得到干燥纯净的氯气,A、B、C装置中导管的连接顺序为a→ ________________ → ________________ → ________________ → ________________ 。
(3)利用D装置,将适量氨气与氯气充分混合,氨气应从__________ 通入,反应的化学方程式为 ___________;可能观察到的现象是________________。
(4)现取岩脑砂进行NH4Cl含量的测定。准确称取一定质量的岩脑砂,与足量的氧化铜混合,如图所示进行实验。已知:2NH4Cl+3CuO![]() 3Cu+N2↑+2HCl↑+3H2O
3Cu+N2↑+2HCl↑+3H2O
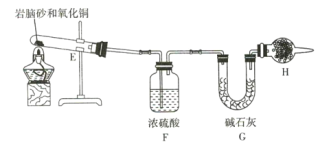
①为顺利完成有关物理量的测定,请完善下列表格。
测量时间点 | 反应前 | 反应后 |
测量内容 | ________________ | 当观察到 ________________ 现象时停止加热,冷却,称量H装置的总质量 |
②如果不用H装置,测出NH4Cl的含量将 _____ (填“偏高”“偏低”或“无影响”)。
【答案】圆底烧瓶 d e b c f 8NH3+3Cl2=6NH4Cl+N2 黄绿色气体消失,有白烟生成 称量G的总质量 F中不再有气泡出现 偏高
【解析】
NH4Cl的制备:A由浓盐酸与MnO2制备Cl2,反应为:MnO2+4H++2Cl-![]() Mn2++Cl2↑+2H2O,制得的氯气混有HCl和水蒸气,依次通过饱和食盐水、浓硫酸除去,为保证除杂充分,导气管均长进短出,得到纯净干燥的氯气,将适量氨气与氯气充分混合反在D中反应:8NH3+3Cl2=6NH4Cl+N2,该反应是个气体体积减少的反应。
Mn2++Cl2↑+2H2O,制得的氯气混有HCl和水蒸气,依次通过饱和食盐水、浓硫酸除去,为保证除杂充分,导气管均长进短出,得到纯净干燥的氯气,将适量氨气与氯气充分混合反在D中反应:8NH3+3Cl2=6NH4Cl+N2,该反应是个气体体积减少的反应。
NH4Cl纯度的测定:E中发生反应2NH4Cl+3CuO![]() 3Cu+N2↑+2HCl↑+3H2O,F中浓硫酸吸收生成的水蒸气,同时观察气体的生成,F中无气泡时,说明NH4Cl反应完全,H中的碱石灰吸收生成HCl气体,由HCl气体的质量,根据氯元素守恒或者方程可得NH4Cl的量,H的作用是防止外界的水蒸气和二氧化碳进入G装置被吸收,增大误差,据此分析作答。
3Cu+N2↑+2HCl↑+3H2O,F中浓硫酸吸收生成的水蒸气,同时观察气体的生成,F中无气泡时,说明NH4Cl反应完全,H中的碱石灰吸收生成HCl气体,由HCl气体的质量,根据氯元素守恒或者方程可得NH4Cl的量,H的作用是防止外界的水蒸气和二氧化碳进入G装置被吸收,增大误差,据此分析作答。
(1)装置A中仪器X的名称为圆底烧瓶;
(2)要先用饱和食盐水除去氯气中的HCl气体,再进行干燥,故要得到干燥纯净的氯气,A、B、C装置中导管的连接顺序为a→d→e→b→c;
(3)氨气的密度小, NH3应从f口进,氯气的密度大于氨气的密度,应从g口进,有利于两种气体充分混合,反应的化学方程式为8NH3+3Cl2=6NH4Cl+N2,可能观察到的现象是:黄绿色气体消失,同时有白烟生成;
(4)E中NH4Cl、CuO发生反应产生HCl、N2、Cu、H2O,反应方程式为:2NH4Cl+3CuO![]() 3Cu+N2↑+2HCl↑+3H2O,G中浓硫酸将气体干燥,当观察到F中不再有气泡出现时,反应结束;G中碱石灰增重的质量为HCl的质量,故加热前要称量G的总质量。②如果不用H装置,空气中的水和二氧化碳会进入G中,使测出NH4Cl的含量将偏高。
3Cu+N2↑+2HCl↑+3H2O,G中浓硫酸将气体干燥,当观察到F中不再有气泡出现时,反应结束;G中碱石灰增重的质量为HCl的质量,故加热前要称量G的总质量。②如果不用H装置,空气中的水和二氧化碳会进入G中,使测出NH4Cl的含量将偏高。


科目:高中化学 来源: 题型:
【题目】祖母绿被称为绿宝石之王,是四大名贵宝石之一,其主要成分为Be3Al2Si6O18,因含有微量的Cr、Ni、Fe元素而呈现各种颜色。回答下列问题:
(1)祖母绿宝石属于晶体,鉴别晶体最可靠的科学方法是_____________。
(2)基态Cr原子的价层电子排布式为_________;基态Si原子电子占据最高能级的电子云轮廓图为_________。
(3)六羰基铬[Cr(CO)6]用于制高纯度铬粉,它的沸点为220℃。Cr(CO)6的晶体类型是_______,1 mol Cr(CO)6中含σ键的数目为_________;
(4)BeCl2分子的空间构型是_________,写出该分子的一种等电子体的分子式_________。它的二聚体Be2Cl4结构如图所示Cl-Be![]() Be-Cl,,其中Be原子的杂化方式是_________。
Be-Cl,,其中Be原子的杂化方式是_________。
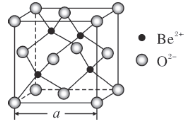
(5)BeO的立方晶胞如图所示,在该晶胞中与一个O2-距离最近且相等的O2-有________个。若该晶体的密度为d g·cm-3,设阿伏加德罗常数的值为NA,则晶胞边长a=________nm。(列出计算表达式)
(6)多数配离子显示颜色与d轨道的分裂能有关。分裂能是指配离子的中心原子(离子)的一个电子从较低能量的d轨道跃迁到较高能量的d轨道所需的能量(用△表示),它与中心离子的结构、电荷、配体有关。试判断分裂能△[Fe(H2O)6]3+________ △[Fe(H2O)6]2+(填“>”、“=”或“<”),理由是___________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】如图所示,把试管放入盛有25 ℃饱和澄清石灰水的烧杯中,试管中开始放入几小块镁片,再用滴管滴入10 mL盐酸于试管中,试回答下列问题:
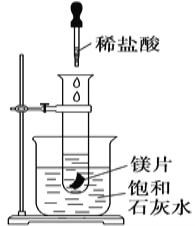
(1)实验中观察到的现象是________________________________ 。
(2)产生上述现象的原因是____________________________。
(3)写出有关反应的离子方程式:_________________________________; 反应中转移了0. 04mol电子时;标准状况下产生多少________mL的H2。
(4)由实验推知,镁片溶液和盐酸的总能量________(填“大于”、“小于”或“等于”) MgCl2和H2的总能量;此反应为________ (填放热反应或者吸热反应)。
查看答案和解析>>
科目:高中化学 来源: 题型:
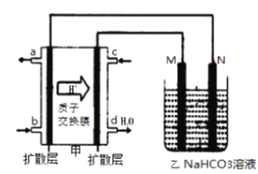
【题目】锌铜原电池装置如图所示,其中阳离子交换膜只允许阳离子和水分子通过,下列有关叙述正确的是
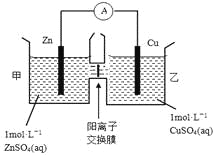
A. 铜电极上发生氧化反应
B. 电池工作一段时间后,甲池的c(SO42-)减小
C. 电池工作一段时间后,乙池溶液的总质量增加
D. 阴阳离子离子分别通过交换膜向负极和正极移动,保持溶液中电荷平衡
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】将11.2 g铁粉投入到盛有100 mL 、3 mol·L-1稀硫酸的烧杯中,4 min时铁粉刚好溶解(溶解前后溶液体积变化忽略不计),下列表示这个反应的速率正确的是
A.v(Fe)=0.5 mol/(L·min)B.v(H2SO4)=1.5 mol/(L·min)
C.v(H2SO4)=0.5 mol/(L·min)D.v(FeSO4)=1 mol/(L·min)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列实验操作或装置能达到目的的是( )
A | B | C | D |
|
|
|
|
混合浓硫酸和乙醇 | 配制一定浓度的溶液 | 收集 | 证明乙炔可使溴水褪色 |
A. AB. BC. CD. D
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】取体积均为1 L的四组X的溶液进行实验(X受热发生分解反应),在不同温度下测得X的物质的量(mol)随时间的变化如下表所示。下列说法不正确的是
| 0 min | 10 min | 20 min | 30 min | 40 min | 50 min | 60 min | |
① | 10°C | 1.1 | 0.90 | 0.80 | 0.73 | 0.68 | 0.65 | 0.65 |
② | 10°C | a | 0.70 | 0.65 | 0.65 | 0.65 | 0.65 | 0.65 |
③ | 25°C | 1.0 | 0.70 | 0.50 | 0.35 | 0.25 | 0.20 | 0.20 |
④ | 30°C | 2.0 | 1.4 | 0.90 | 0.50 | 0.20 | 0.13 | 0.13 |
A.在0~10 min内,实验③④中X的转化率相同
B.实验②中改变的条件可能是加入催化剂
C.在10~20 min内,实验①中X的平均分解速率为0.01 mol L-1min-1
D.对比实验①和④,能说明X的反应速率随温度升高而增大
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某镁铝合金MgxAly(其中x、y为整数)是贮氢材料,可在通入氩气的条件下,将一定化学计量比的Al、Mg单质在一定温度下熔炼制得.为测定该合金的成分,称取一定质量的样品放入600mL稀硫酸中,样品全部溶解并产生气体.待反应完全后,向所得溶液中加入NaOH溶液,生成沉淀的物质的量与NaOH溶液的体积关系如图所示.完成下列问题:
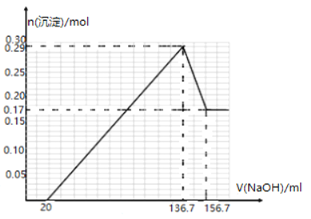
(1)熔炼制取镁铝合金(MgxAly)时通入氩气的目的是_____________。
(2)NaOH溶液的物质的量浓度为____________。
(3)该镁铝合金(MgxAly)的化学式为_____________。
(4)该合金在一定条件下吸氢的化学方程式为:MgxAly+xH2═xMgH2+yA1,得到的混合物在6.0mol·L-1HCl溶液中能完全释放出H2,1mol MgxAly完全吸氢后得到的混合物与上述盐酸完全反应,释放出H2的物质的量为__________________。
(5)将该镁铝合金置于NaOH溶液可以构成原电池,写出负极发生的反应_____________________。
(6)如图甲为甲醇燃料电池,乙池为铝制品表面“钝化”装置,两极分别为铝制品和石墨.M电极的材料是_________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】钾和碘的相关化合物在化工医药材料等领域有广泛的应用。回答下列问题:
(1)IO3-离子的立体构型的名称为____,中心原子的杂化方式为____。
(2)HIO4的酸性强于HIO3,其原因为____。
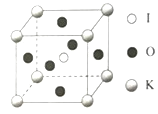
(3)KIO3晶体是一种性能良好的非线性光学材料,晶胞如图。晶胞的棱长为a=0.446nm,晶胞中K、I、O分别处于顶角、体心、面心位置,K与I间的最短距离为____nm,与K紧邻的O的个数为____。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com