
【题目】下列关于热化学反应的描述中正确的是
A.HCl和NaOH反应的中和热△//=-57.3kJ/mol,则H2SO4和Ca(OH)2反应的中和热△=2×(-57.3)kJ/mol
B.需要加热才能发生的反应一定是吸热反应
C.CO(g)的燃烧热是283.0kJ/mol,则2CO2(g)=2CO(g)+O2(g)反应的△H=+2×283.0kJ/mo1
D.1 mol甲烷燃烧生成气态水和二氧化碳所放出的热量是甲烷的燃烧热
【答案】C
【解析】
A.中和热是指生成1mol水放出的热量,H2SO4和Ca(OH)2反应生成硫酸钙和水,硫酸钙是微溶物,生成硫酸钙也要放热,A错误;
B.需要加热才能发生的反应不一定是吸热反应,有些放热反应也需要加热,例如:N2(g)+3H2(g)![]() 2NH3(g) ΔH<0,B错误;
2NH3(g) ΔH<0,B错误;
C.燃烧热是1mol纯净物完全燃烧生成稳定的氧化物放出的热量,则2CO2(g)=2CO(g)+O2 (g)反应的△H=+2×283.0kJ/mol,C正确;
D.燃烧热是1mol纯净物完全燃烧生成稳定的氧化物放出的热量,故1 mol甲烷燃烧生成液态水和二氧化碳所放出的热量是甲烷的燃烧热,D错误;
答案选C。


科目:高中化学 来源: 题型:
【题目】取体积均为1 L的四组X的溶液进行实验(X受热发生分解反应),在不同温度下测得X的物质的量(mol)随时间的变化如下表所示。下列说法不正确的是
| 0 min | 10 min | 20 min | 30 min | 40 min | 50 min | 60 min | |
① | 10°C | 1.1 | 0.90 | 0.80 | 0.73 | 0.68 | 0.65 | 0.65 |
② | 10°C | a | 0.70 | 0.65 | 0.65 | 0.65 | 0.65 | 0.65 |
③ | 25°C | 1.0 | 0.70 | 0.50 | 0.35 | 0.25 | 0.20 | 0.20 |
④ | 30°C | 2.0 | 1.4 | 0.90 | 0.50 | 0.20 | 0.13 | 0.13 |
A.在0~10 min内,实验③④中X的转化率相同
B.实验②中改变的条件可能是加入催化剂
C.在10~20 min内,实验①中X的平均分解速率为0.01 mol L-1min-1
D.对比实验①和④,能说明X的反应速率随温度升高而增大
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】石油是由多种碳氢化合物组成的混合物,石油精炼可以获得多种化工原料。

请根据上图回答下列问题:
(1)由原油获得汽油,分离的方法是__________________________。
(2)丙烯在一定条件下生成聚丙烯,这种高分子化合物的链节为____________________________。
(3)石油裂化是为了得到更多的汽油,裂化汽油可以使溴的四氯化碳溶液褪色,其原因是_______。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】钾和碘的相关化合物在化工医药材料等领域有广泛的应用。回答下列问题:
(1)IO3-离子的立体构型的名称为____,中心原子的杂化方式为____。
(2)HIO4的酸性强于HIO3,其原因为____。
(3)KIO3晶体是一种性能良好的非线性光学材料,晶胞如图。晶胞的棱长为a=0.446nm,晶胞中K、I、O分别处于顶角、体心、面心位置,K与I间的最短距离为____nm,与K紧邻的O的个数为____。
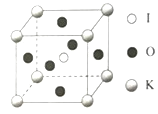
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】a、b、c、d、e为原子序数依次增大的五种常见短周期元素,可组成一种化合物A,其化学式为ba4d(ec4)2。A能够发生如下转化关系:

己知C的分子式为ba3,能使湿润的红色石蕊试纸变蓝。则下列说法正确的是
A.原子半径b>c
B.e的氧化物的水化物为强酸
C.化合物A为共价化合物
D.元素非金属性强弱c<e
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】Na2SO3是一种白色粉末,工业上可用作还原剂、防腐剂等。某化学小组探究不同pH的Na2SO3溶液与同浓度AgNO3溶液反应的产物,进行如下实验。
实验Ⅰ 配制500 mL 一定浓度的Na2SO3溶液
①溶解:准确称取一定质量的Na2SO3晶体,用煮沸的蒸馏水溶解。蒸馏水需煮沸的原因是____
②移液:将上述溶解后的Na2SO3溶液在烧杯中冷却后转入仪器A中,则仪器A为 __,同时洗涤____(填仪器名称)2~3次,将洗涤液一并转入仪器A中;
③定容:加水至刻度线1~2 cm处,改用胶头滴管滴加蒸馏水至液面与刻度线相切,盖好瓶塞,反复上下颠倒,摇匀。
实验Ⅱ 探究不同pH的Na2SO3溶液与pH=4的AgNO3溶液反应的产物
查阅资料:i.Ag2SO3为白色固体,不溶于水,溶于过量Na2SO3溶液
ii.Ag2O,棕黑色固体,不溶于水,可与浓氨水反应
(1)将pH=8的Na2SO3溶液滴人pH=4的AgNO3溶液中,至产生白色沉淀。
假设一:该白色沉淀为Ag2SO3
假设二:该白色沉淀为Ag2SO4
假设三:该白色沉淀为Ag2SO3和Ag2SO4的混合物
①写出假设一的离子方程式 ____;
②提出假设二的可能依据是_____;
③验证假设三是否成立的实验操作是____。
(2)将pH=4的AgNO3溶液逐滴滴人足量的pH=11的Na2SO3溶液中,开始产生白色沉淀A,然后变成棕黑色物质。为了研究白色固体A的成分,取棕黑色固体进行如下实验:
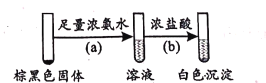
①已知反应(b)的化学方程式为Ag(NH3)2OH+3HCl=AgCl↓+2NH4Cl+H2O,则反应(a)的化学方程式为____;
②生成白色沉淀A的反应为非氧化还原反应,则A的主要成分是____(写化学式)。
(3)由上述实验可知,盐溶液间的反应存在多样性。经验证,(1)中实验假设一成立,则(2)中实验的产物不同于(1)实验的条件是 ___。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】运用有关概念判断下列叙述正确的是( )
A.1mol H2燃烧放出的热量为H2的燃烧热
B.Na2SO3和H2O2的反应为氧化还原反应
C.![]() 和
和![]() 互为同系物
互为同系物
D.BaSO4的水溶液不导电,故BaSO4是弱电解质
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】香豆素衍生物Q是合成抗肿瘤、抗凝血药的中间体,其合成路线如图。
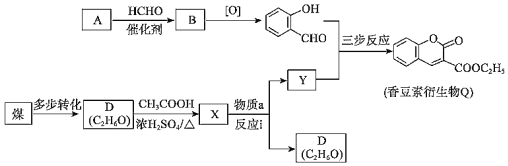
已知:Ⅰ.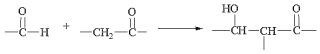
Ⅱ.RCOOR′+R″OH→RCOOR″+R′OH
(1)A的分子式为C6H6O,能与饱和溴水反应生成白色沉淀。
①按官能团分类,A的类别是_____。
②生成白色沉淀的反应方程式是_____。
(2)A→B的反应方程式是_____。
(3)D→X的反应类型是_____。
(4)物质a的分子式为C5H10O3,核磁共振氢谱有两种吸收峰,由以下途径合成:
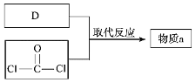
物质a的结构简式是_____。
(5)反应i为取代反应。Y只含一种官能团,Y的结构简式是_____。
(6)生成香豆素衍生物Q的“三步反应”,写出其第三步反应方程式_____。
(7)研究发现,一定条件下将香豆素衍生物Q水解、酸化生成![]() ,其水溶性增强,更有利于合成其他药物。请说明其水溶性增强的原因:_____。
,其水溶性增强,更有利于合成其他药物。请说明其水溶性增强的原因:_____。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】决定物质性质的重要因素是物质结构。请回答下列问题:
(1)已知元素M是组成物质Ca5(PO4)3F的一种元素。元素M的气态原子逐个失去第1个至第5个电子所需能量(即电离能,用符号I1至I5表示)如表所示:
电离能 | I1 | I2 | I3 | I4 | I5 |
电离能/(kJ·mol-1) | 589.8 | 1145.4 | 4912.4 | 6491 | 8153 |
元素M化合态常见化合价是________价,其基态原子电子排布式为________________。
(2)Ca3(PO4)3F中非金属元素电负性由大到小的顺序为________________。
(3)PO43-的中心原子的杂化方式为________,该离子的空间构型为________,键角为________,其等电子体有________(请写出两种)。
(4)已知MgO与CaO的晶体结构相似,其摩氏硬度的大小关系为________,原因为__________________。
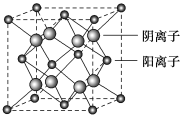
(5)CaF2晶胞结构如图所示,则CaF2晶体中与Ca2+最近且等距离的Ca2+数目为________;已知Ca2+和F-半径分别为a cm、b cm,阿伏加德罗常数为NA,M为摩尔质量,则晶体密度为________ g·cm-3(不必化简)。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com