
��4���ƵĻ�����W��X��Y��Z������֮��������¹�ϵ��
��W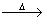 X+H2O+CO2�� ��Z+CO2����X+O2
X+H2O+CO2�� ��Z+CO2����X+O2
��Z+H2Oһ��Y+O2�� ��X+Ca(OH)2����Y+CaCO3��
��1��W��X��Y��Z�Ļ�ѧʽ�ֱ��ǣ�W��________��X________��Y________��Z________��
��2������4����ѧ��Ӧ������������ԭ��Ӧ����________���Ӧ��ţ�����Ӧ����������________��д��ѧʽ������ԭ����________��д��ѧʽ����
��3�����ܷ�Ӧ����Һ�н��У�д�������ӷ���ʽ�Լ����ø����ӷ���ʽ��ʾ����һ����ѧ��Ӧ�Ļ�ѧ����ʽ�������ӷ���ʽ��________���ڻ�ѧ����ʽ��________��

| �꼶 | ���пγ� | �꼶 | ���пγ� |
| ��һ | ��һ��ѿγ��Ƽ��� | ��һ | ��һ��ѿγ��Ƽ��� |
| �߶� | �߶���ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
| ���� | ������ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
һ�������£�X(g)+3Y(g)  2Z(g)�ﵽƽ��ı�־�ǣ� ��
2Z(g)�ﵽƽ��ı�־�ǣ� ��
A��Z�ķֽ����ʺ������������
B��X��Y��Z��Ũ�ȱ�Ϊ1:3:2
C����Ӧ��ϵ�����������ֲ���
D����λʱ��������nmolZ��ͬʱ����nmolX
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����������������ɢϵ�ı��������� �� ��
A������ķ�ɢ����ͨ����ֽ��϶������Һ�ķ�ɢ�ʲ���
B���������������
C����ɢ������ֱ����1nm��100nm֮��
D��������һ�����������ȶ�����
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
x g Na2O��y g Na2O2�ֱ�����������ˮ�У�ˮ������������õ���������������Һ����x��y��ϵ��ȷ���ǣ� ����
A��x=y B��x��y C��x��y D����ȷ��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
��4.6 g������Ͷ�뵽95.6 gˮ�У��õ�����Һ���ʵ���������Ϊ�� ����
A��4.6�� B��7.6�� C��8�� D��10��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
1 mol����������2 mol̼�����ƹ����Ϻ����ܱ������м��ȳ�ַ�Ӧ���ų��������ʺ���ȴ�������Ĺ��������ǣ� ����
A��Na2CO3 B��Na2O2 Na2CO3 C��NaOH Na2CO3 D��Na2O2 NaOH Na2CO3
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
���������ΰ�һ��������Ϻ��ۣ����Ƶû�����X��X����ˮ�ܵ����K����Cr3+��SO42��������2.83 g X�е�Cr3+ȫ������ΪCr2O72������Һ�е�Cr2O72���ɺ���KI��Һ��Ӧ���õ�3.81g I2����Ӧ�����ӷ���ʽΪ��Cr2O72����6I����14H+��2 Cr3+��3I2��7H2O ����������2.83 gX����Һ�У����������BaCl2��Һ���ɵõ�4.66 g��ɫ�������ɴ˿��ƶϳ�X�Ļ�ѧʽΪ
A����K 2SO4 ��2Cr2��SO4��3�������� B�� 2K 2SO4 ��Cr2��SO4��3
C�� K 2SO4 ��Cr2��SO4��3�������� �� D�� K 2SO4 ��1/2Cr2��SO4��3
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
��ijŨ�ȵĸ��ᣨH2CrO4����Һ�еμ�NaOH��Һ��������Ũ�ȣ�mol/L����pH�Ĺ�ϵ���±�������˵������ȷ����
| pH | c(CrO42-) | c(HCrO4-) | c(Cr2O72-) | c(H2CrO4) |
| 4 | 0.0003 | 0.1030 | 0.4480 | 0 |
| 6 | 0.0319 | 0.0899 | 0.4370 | 0 |
| 7 | 0.2645 | 0.0860 | 0.3195 | 0 |
| 9 | 0.8960 | 0.0031 | 0.0004 | 0 |
A.����ĵ�һ�����뷽��ʽΪ��H2CrO4 = H+ + HCrO4-
B.�ø�����Һ�����ʵ���Ũ��ԼΪ1.00 mol/L
C. pHԽ��HCrO4-Խ�������CrO42-
D. NaHCrO4��Һ�У�c(OH-)��c(H+)
�鿴�𰸺ͽ���>>
����ѧУ��ѡ - ��ϰ���б� - �����б�
����ʡ������Υ���Ͳ�����Ϣ�ٱ�ƽ̨ | �����к���Ϣ�ٱ�ר�� | ����թƭ�ٱ�ר�� | ����ʷ���������к���Ϣ�ٱ�ר�� | ������Ȩ�ٱ�ר��
Υ���Ͳ�����Ϣ�ٱ��绰��027-86699610 �ٱ����䣺58377363@163.com