
向某浓度的铬酸(H2CrO4)溶液中滴加NaOH溶液,各粒子浓度(mol/L)与pH的关系如下表,下列说法不正确的是
| pH | c(CrO42-) | c(HCrO4-) | c(Cr2O72-) | c(H2CrO4) |
| 4 | 0.0003 | 0.1030 | 0.4480 | 0 |
| 6 | 0.0319 | 0.0899 | 0.4370 | 0 |
| 7 | 0.2645 | 0.0860 | 0.3195 | 0 |
| 9 | 0.8960 | 0.0031 | 0.0004 | 0 |
A.铬酸的第一步电离方程式为:H2CrO4 = H+ + HCrO4-
B.该铬酸溶液的物质的量浓度约为1.00 mol/L
C. pH越大,HCrO4-越容易电离出CrO42-
D. NaHCrO4溶液中:c(OH-)>c(H+)
科目:高中化学 来源: 题型:
有4种钠的化合物W、X、Y、Z,它们之间存在如下关系:
①W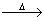 X+H2O+CO2↑ ②Z+CO2—→X+O2
X+H2O+CO2↑ ②Z+CO2—→X+O2
③Z+H2O一→Y+O2↑ ④X+Ca(OH)2—→Y+CaCO3↓
(1)W、X、Y、Z的化学式分别是:W:________、X________、Y________、Z________。
(2)以上4个化学反应,属于氧化还原反应的是________(填反应序号),反应中氧化剂是________(写化学式),还原剂是________(写化学式)。
(3)若④反应在溶液中进行,写出其离子方程式以及能用该离子方程式表示的另一个化学反应的化学方程式:①离子方程式:________。②化学方程式:________。
查看答案和解析>>
科目:高中化学 来源: 题型:
230Th和232Th是钍的两种同位素,232Th可以转化成233U.下列有关Th的说法正确的是( )
A.Th元素的质量数是232 B.Th元素的相对原子质量是231
C.232Th转化成233U是化学变化 D.230Th和232Th的化学性质相同[来
查看答案和解析>>
科目:高中化学 来源: 题型:
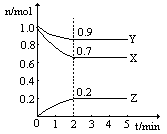
某温度时,在一个2L的密闭容器中,X、Y、Z三种物质的物质的量随时间的变化曲线如图所示。根据图中数据,试填写下列空白:
(1)该反应的化学方程式为
(2)从开始至2min,Z的平均反应速率为
查看答案和解析>>
科目:高中化学 来源: 题型:
(一) A、B、C、D是按原子序数由小到大排列的第二、三周期元素的单质。B、E均为组成空气的成分。F的焰色反应呈黄色。在G中,非金属元素与金属元素的原子个数比为1∶2。在一定条件下,各物质之间的相互转化关系如下图(图中部分产物未列出):
请填写下列空白:
(1)G是 。(用化学式填写)
(2)E与F反应的化学反应方程式是 。
(3)F与G的水溶液的反应生成I和D的离子方程式是 。
 (4)将2.5 g H、I和碳酸氢钠的固体混合物完全溶解于水,制成稀溶液,然后向该溶液中逐滴加入1mol·L-1的盐酸,所加入盐酸
(4)将2.5 g H、I和碳酸氢钠的固体混合物完全溶解于水,制成稀溶液,然后向该溶液中逐滴加入1mol·L-1的盐酸,所加入盐酸 的体积与产生CO2的体积(标准状况)关系如下图所示:
的体积与产生CO2的体积(标准状况)关系如下图所示:
则物质I的物质的量为_______________mol。
(二)工业上采用乙苯与CO2脱氢生产重要化工原料苯乙烯
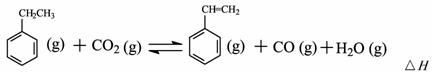 = -166KJ/mol
= -166KJ/mol
(1)在3L密闭容器内,乙苯与CO2的反应在三种不同的条件下进行实验,乙苯、CO2的起始浓度分别为1.0mol/L和3.0mol/L,其中实验Ⅰ在T1℃,0.3MPa,而实验II、III分别改变了实验其他条件;乙苯的浓度随时间的变化如图Ⅰ所示。
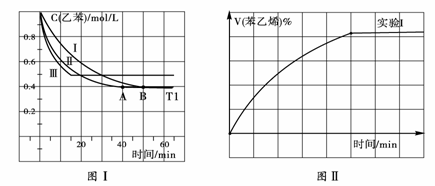
① 实验I乙苯在0—50min时的反应速率为
② 实验Ⅱ可能改变条件的是
③图II是实验Ⅰ中苯乙烯体积分数V%随时间t的变化曲线,请在图II中补画实验Ⅲ中苯乙烯体
积分数V%随时间t的变化曲线。
(2)若实验Ⅰ中将乙苯的起始浓度改为1.2 mol/L,其他条件不变,乙苯的转化率将 (填“增大”、“减小”或“不变”),计算此时平衡常数为 。
查看答案和解析>>
科目:高中化学 来源: 题型:
化学与生产、生活密切相关。下列叙述正确的是( )
A.煤的干馏和石油的分馏均属化学变化
B.BaSO4在医学上用作钡餐,Ba2+对人体无毒
C.14C可用于文物的年代鉴定,14C与12C互为同素异形体
D.葡萄糖注射液不能产生丁达尔现象,不属于胶体
查看答案和解析>>
科目:高中化学 来源: 题型:
已知25 ℃、101 kPa条件下:
4Al(s)+3O2(g)===2Al2O3(s) ΔH=-2 834. 9 kJ·mol-1
4Al(s)+2O3(g)===2Al2O3(s) ΔH=-3 119.1 kJ·mol-1 由此得出的正确结论是( )
①等质量的O2比O3能量低; ②等质量的O2比O3能量高;
③等质量的O3比O2稳定; ④等质量的O2比O3稳定;
A.①③ B.①④ C.②③ D.②④
查看答案和解析>>
科目:高中化学 来源: 题型:
实验室用固体烧碱配制500 mL 0.1 mol/L的NaOH溶液。
(1)需称量________g的烧碱固体,固体应放在________中称量。
(2)配制过程中,不需要使用的仪器是(填代号)________。
A.烧杯 B.量筒 C.玻璃棒
D.1000 mL容量瓶 E.漏斗 F.胶头滴管
(3)完成该实验还需要的仪器是________________。
(4)在容量瓶确定溶液体积的过程中,完成后期加入少量水的操作是________________。
(5)为什么容量瓶设计为细颈?
(6)下列操作使得溶液浓度偏高、偏低、不变?
①将取药品的药匙用水洗涤,洗涤液倒入容量瓶中,则所配溶液浓度________。
②定容摇匀后,有少量溶液外流,则所配溶液浓度________。
③未将溶液冷却,直接转移到容量瓶,则引起结果________。
④称量时间过长,所配溶液浓度________。
⑤称量时所用砝码生锈,则引起结果________。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com