
实验室用固体烧碱配制500 mL 0.1 mol/L的NaOH溶液。
(1)需称量________g的烧碱固体,固体应放在________中称量。
(2)配制过程中,不需要使用的仪器是(填代号)________。
A.烧杯 B.量筒 C.玻璃棒
D.1000 mL容量瓶 E.漏斗 F.胶头滴管
(3)完成该实验还需要的仪器是________________。
(4)在容量瓶确定溶液体积的过程中,完成后期加入少量水的操作是________________。
(5)为什么容量瓶设计为细颈?
(6)下列操作使得溶液浓度偏高、偏低、不变?
①将取药品的药匙用水洗涤,洗涤液倒入容量瓶中,则所配溶液浓度________。
②定容摇匀后,有少量溶液外流,则所配溶液浓度________。
③未将溶液冷却,直接转移到容量瓶,则引起结果________。
④称量时间过长,所配溶液浓度________。
⑤称量时所用砝码生锈,则引起结果________。
(1)2.0 烧杯 (2)B、D、E (3)500 mL容量瓶
(4)当容量瓶中液面上升到离刻度线1~2 cm处,改用胶头滴管进行定容,应逐滴加水,当凹液面最低处与刻度线相平时,立即停止加水
(5)便于观察加液情况,减小配制误差(原理是直径5 mm的容器和直径10 cm的容器同样误差0.1 mm的高度,哪一个溶液的体积差的多,即哪一个误差大)。
(6)①偏高 ②不变 ③偏高 ④偏低 ⑤偏高
【解析】本题考查一定物质的量浓度溶液配制中相关问题。配制一定物质的量浓度的溶液时,一般用托盘天平。这就决定了计算的数据也应与托盘天平的精确度相匹配,保留到小数点后一位,故应称量2.0 g。NaOH固体易潮解,且有很强的腐蚀性,应盛在小烧杯中称量且时间不要过长。药匙上的药品并未称量,洗涤后一并转入容量瓶,显然会使结果偏高。砝码锈蚀,会使所称量的固体质量偏大,结果偏高。
提示:本题是对一定物质的量浓度溶液的配制从仪器、配制过程、具体操作、误差分析诸方面进行考查。对这一重要的定量实验,应从原理、仪器、操作过程、重要技能(如查漏、定容等)等方面熟练掌握,特别是要注意一些细节问题。


科目:高中化学 来源: 题型:
向某浓度的铬酸(H2CrO4)溶液中滴加NaOH溶液,各粒子浓度(mol/L)与pH的关系如下表,下列说法不正确的是
| pH | c(CrO42-) | c(HCrO4-) | c(Cr2O72-) | c(H2CrO4) |
| 4 | 0.0003 | 0.1030 | 0.4480 | 0 |
| 6 | 0.0319 | 0.0899 | 0.4370 | 0 |
| 7 | 0.2645 | 0.0860 | 0.3195 | 0 |
| 9 | 0.8960 | 0.0031 | 0.0004 | 0 |
A.铬酸的第一步电离方程式为:H2CrO4 = H+ + HCrO4-
B.该铬酸溶液的物质的量浓度约为1.00 mol/L
C. pH越大,HCrO4-越容易电离出CrO42-
D. NaHCrO4溶液中:c(OH-)>c(H+)
查看答案和解析>>
科目:高中化学 来源: 题型:
下列说法中正确的是
A.同温同压下,H2(g)+Cl2(g)=2HCl(g)在光照和点燃条件下的ΔH不同
B.常温下,2A(s)+B(g)=2C(g)+D(g)不能自发进行,该反应焓变一定大于零
C.1mol硫酸与1molBa(OH)2完全中和所放出的热量为中和热
D.在25℃、101KPa时,2mol S的燃烧热是1mol S的2倍
查看答案和解析>>
科目:高中化学 来源: 题型:
用10mL的0.1 mol·L-1BaCl2溶液恰好使同体积的硫酸铁.硫酸锌和硫酸钾三种溶液中的SO 完全沉淀,则这三种溶液的物质的量浓度之比为( )
完全沉淀,则这三种溶液的物质的量浓度之比为( )
A.3:2:2 B.1:2:3 C.1:3:3 D.3:1:1
查看答案和解析>>
科目:高中化学 来源: 题型:
科学家刚刚发现了某种元素的原子,其质量是a g,12C的原子质量是b g,NA是阿伏加德罗常数的值,下列说法正确的是( )
A.该原子的摩尔质量是a NA
B.W g该原子的物质的量一定是
C.W g该原子中含有a个该原子
D.由已知信息可得:
查看答案和解析>>
科目:高中化学 来源: 题型:
要除掉粗盐中含有的氯化镁、硫酸镁等杂质。现设计一个除杂质的方案:把盐溶液溶于水,过滤成澄清溶液,再进行下列各步骤的处理:①加入氯化钡溶液至沉淀完全;②用盐酸调节pH至溶液呈微酸性;③加入NaOH溶液至沉淀完全;④过滤废弃滤出的沉淀;⑤加入碳酸钠溶液至沉淀完全;⑥蒸发浓缩使NaCl晶体析出。对上述各处理步骤的顺序安排合理的是( )
A.①②③④⑤⑥ B.③①⑤④②⑥ C.②①③④⑤⑥ D.②③⑤④①⑥
查看答案和解析>>
科目:高中化学 来源: 题型:
质量分数为W的NaOH溶液,其物质的量浓度为a,如热蒸发水分使其质量分数变为2W,此时该溶液中NaOH的物质量浓度为b,则a与b的关系正确的是( )
A.b=2a B.a=2b C.b>2a D.b<2a
查看答案和解析>>
科目:高中化学 来源: 题型:
盐酸、醋酸和碳酸氢钠是生活中常见的物质。下列表述正确的是( )
A.在NaHCO3溶液中加入与其等物质的量的NaOH,溶液中的阴离子只有CO 和OH-
和OH-
B.NaHCO3溶液中:c (H+)+ c (H2CO3)=c(OH-)
C.10 mL0.10 mol·L-1CH3COOH溶液加入等物质的量的NaOH后,溶液中离子的浓度由大到小的顺序是:c(Na+)>c(CH3COO-)>c(OH-)>c(H+)
D.中和体积与pH都相同的HCl溶液和CH3COOH溶液所消耗的NaOH物质的量相同
查看答案和解析>>
科目:高中化学 来源: 题型:
28(10分)水钴矿中除SiO2外,还有9.24% CoO、2.78% Fe2O3、0.96% MgO、0.084 % CaO。从中提 取钴的主要工艺流程如下:
取钴的主要工艺流程如下:

(1)请配平下列除铁的化学方程式:
Fe2(SO4)3+ H2O+ Na2CO3= Na2Fe6(SO4)4(OH)12↓+ Na2SO4+ CO2↑
(2)“除钙、镁”的原理反应为:
MgSO4+2NaF=MgF2↓+Na2SO4,CaSO4+2NaF=CaF2↓+Na2SO4
已知KSP(CaF2)=1.11×10-10,KSP(MgF2)=7.40×10-11,加入过量NaF溶液反应完全后过滤,则滤液中 。
。
(3)“沉淀”中含杂质离子主要有SO42-、F-、 和 ;“操作X”包括 和 。
(4)向氯化铜溶液中加入一定量的铁粉和铝粉混合物,充分反应后,下列情况可能出现的是________
a.溶液中有Cu2+、Fe2+、Al3+,不溶物为Cu
 b.溶液中有Fe2+、Al3+,不溶物为Cu、Fe
b.溶液中有Fe2+、Al3+,不溶物为Cu、Fe
c.溶液中有Fe3+、Al3+,不溶物为Cu
d.溶液中有Fe2+,不溶物为Cu、Al
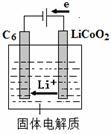
(5)某锂离子电池正极是LiCoO2,含Li+导电固体为电解质。充电时,Li+还原为Li,并以原子形式嵌入电池负极材料碳-6(C6)中(如图所示)。电池反应为
 LiCoO2 + C6 CoO2 + LiC6 ,写出该电池放电时的正极反应式 。
LiCoO2 + C6 CoO2 + LiC6 ,写出该电池放电时的正极反应式 。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com