
解析:镁铝合金能与盐酸反应放出氢气,生成氯化镁、氯化铝,再与加入的氨水反应生成氢氧化镁和氢氧化铝沉淀。
解法一:根据合金的总质量和放出气体的体积,可以算出镁铝合金中镁、铝的量,进而计算出产生沉淀氢氧化镁和氢氧化铝的总质量。
Mg — H2 2Al — 3H2
x x y 1.5y
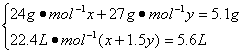
由此解得:x=0.1 mol,y=0.1 mol
根据元素守恒,列出关系式:
Mg—Mg(OH)2 Al—Al(OH)3
0.1 0.1 0.1 0.1
解得,两种沉淀的总质量共13.6 g。
解法二:根据合金和盐酸反应放出氢气的总体积,可以算出镁、铝失去的电子总数,进而得出Mg2+、Al3+形成氢氧化物沉淀时增加的OH-的量,再算得沉淀总质量。
H2—2e- — 2OH-(Mg2+、Al3+形成氢氧化物沉淀时增加的质量)
1 mol 2×17 g
5.6 L×22.4 L·mol-1 z
解得z=8.5 g
两种沉淀的总质量共8.5 g+5.1 g=13.6 g。
答案:13.6 g


 举一反三期末百分冲刺卷系列答案
举一反三期末百分冲刺卷系列答案科目:高中化学 来源: 题型:
A.5.1 g B.10.2 g C.13.6 g D.15.3 g
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
A.5.1 g B.10.2 g C.13.6 g D.15.3 g
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com