
| A、①③ | B、②④ | C、①④ | D、②③ |


 赢在课堂名师课时计划系列答案
赢在课堂名师课时计划系列答案 天天向上课时同步训练系列答案
天天向上课时同步训练系列答案 阳光课堂同步练习系列答案
阳光课堂同步练习系列答案科目:高中化学 来源: 题型:
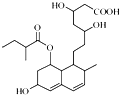 普伐他汀是一种调节血脂的药物,其结构如图所示(未表示出其空间构型).下列关系普伐他汀的性质描述正确的是( )
普伐他汀是一种调节血脂的药物,其结构如图所示(未表示出其空间构型).下列关系普伐他汀的性质描述正确的是( )| A、能与FeCl3溶液发生显色反应 |
| B、能使酸性KMnO4溶液褪色 |
| C、1mol该物质与足量钠发生反应生成4molH2 |
| D、1mol该物质最多可与1molNaOH反应 |
查看答案和解析>>
科目:高中化学 来源: 题型:
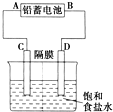 如图是以铅蓄电池为电源,模拟氯碱工业电解饱和食盐水的装置图(C、D均为石墨电极).已知:铅蓄电池在放电时发生下列电极反应:负极Pb+SO42--2e-═PbSO4
如图是以铅蓄电池为电源,模拟氯碱工业电解饱和食盐水的装置图(C、D均为石墨电极).已知:铅蓄电池在放电时发生下列电极反应:负极Pb+SO42--2e-═PbSO4查看答案和解析>>
科目:高中化学 来源: 题型:
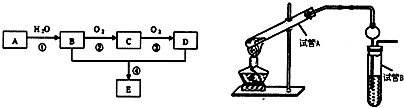
| 光照 |
查看答案和解析>>
科目:高中化学 来源: 题型:
A、
| ||
| B、a mol?L-1 | ||
| C、2a mol?L-1 | ||
| D、无法确定 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、开启啤酒瓶后,瓶中马上泛起大量泡沫 |
| B、工业上合成氨时,为了提高氢气的转化率采用高温的条件 |
| C、实验室中常用排饱和食盐水的方法收集氯气 |
| D、工业上生产硫酸的过程中使用过量的空气以提高二氧化硫的利用率 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、混合气体压强 |
| B、混合气体的密度 |
| C、混合气体的平均相对分子质量 |
| D、B的物质的量浓度 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、元素C在周期表中的位置是第三周期第ⅤA族 |
| B、在等体积、等pH的X、Y溶液中分别加入等质量的锌粉,充分反应后仅有一份溶液中存在锌粉,则反应过程中两溶液中反应速率的大小关系是:X<Y |
| C、由A、B、C、D四种元素形成的化合物一定只有共价键 |
| D、25℃时,将W溶液与Y溶液等体积混合,充分反应后若pH=7则c(W)>c(Y) |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com