
| A、开启啤酒瓶后,瓶中马上泛起大量泡沫 |
| B、工业上合成氨时,为了提高氢气的转化率采用高温的条件 |
| C、实验室中常用排饱和食盐水的方法收集氯气 |
| D、工业上生产硫酸的过程中使用过量的空气以提高二氧化硫的利用率 |


科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、电解开始时,阴极有H2放出 |
| B、电解开始时,阳极上发生:Cu2++2e-═Cu |
| C、当电路中通过电子的量超过0.1mol时,阴极放电的种类将发生变化 |
| D、整个电解过程中,SO42-不参加电极反应 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| 甲 | 乙 | 丙 |
| 氨水 | KOH | K2CO3 |
| A、甲>乙>丙 |
| B、乙>甲>丙 |
| C、丙>乙>甲 |
| D、丙>甲>乙 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、①③ | B、②④ | C、①④ | D、②③ |
查看答案和解析>>
科目:高中化学 来源: 题型:
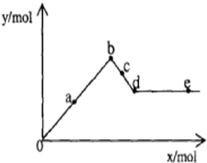 已知Ba(AlO2)2可溶于水.如图表示的是向Al2(SO4)3溶液中逐滴加入Ba(OH)2溶液时,生成沉淀的物质的量y与加入Ba(OH)2的物质的量x的关系.下列有关叙述错误的是( )
已知Ba(AlO2)2可溶于水.如图表示的是向Al2(SO4)3溶液中逐滴加入Ba(OH)2溶液时,生成沉淀的物质的量y与加入Ba(OH)2的物质的量x的关系.下列有关叙述错误的是( )| A、d-e 时溶液中离子的物质的量:Ba2+可能等于AlO2- |
| B、b-c 时溶液中离子的物质的量:AlO2-比Ba2+多 |
| C、a-d 时沉淀的物质的量:Al(OH)3一定小于BaSO4 |
| D、a-b 时沉淀的物质的量:Al(OH)3比BaSO4多 |
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、降温 |
| B、不用稀硫酸,改用98%的浓硫酸 |
| C、不用稀硫酸,改用稀硝酸 |
| D、滴加少量CuSO4溶液 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com