
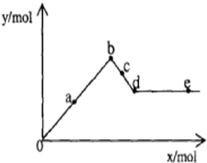
 已知Ba(AlO2)2可溶于水.如图表示的是向Al2(SO4)3溶液中逐滴加入Ba(OH)2溶液时,生成沉淀的物质的量y与加入Ba(OH)2的物质的量x的关系.下列有关叙述错误的是( )
已知Ba(AlO2)2可溶于水.如图表示的是向Al2(SO4)3溶液中逐滴加入Ba(OH)2溶液时,生成沉淀的物质的量y与加入Ba(OH)2的物质的量x的关系.下列有关叙述错误的是( )| A、d-e 时溶液中离子的物质的量:Ba2+可能等于AlO2- |
| B、b-c 时溶液中离子的物质的量:AlO2-比Ba2+多 |
| C、a-d 时沉淀的物质的量:Al(OH)3一定小于BaSO4 |
| D、a-b 时沉淀的物质的量:Al(OH)3比BaSO4多 |


科目:高中化学 来源: 题型:
| A、氢氧化钠中和等体积该条件下的盐酸和碳酸时,盐酸消耗的氢氧化钠多 |
| B、相同体积的盐酸和碳酸与足量的亚硫酸氢钠反应时,碳酸产生的SO2多 |
| C、两溶液的导电能力几乎相同 |
| D、溶液中离子总数一定不相等 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、开启啤酒瓶后,瓶中马上泛起大量泡沫 |
| B、工业上合成氨时,为了提高氢气的转化率采用高温的条件 |
| C、实验室中常用排饱和食盐水的方法收集氯气 |
| D、工业上生产硫酸的过程中使用过量的空气以提高二氧化硫的利用率 |
查看答案和解析>>
科目:高中化学 来源: 题型:
 在体积一定的密闭容器中给定物质A、B、C的量,在一定条件下发生反应建立的化学平衡:aA(g)+bB(g)?xC(g),符合如图所示的关系(c%表示平衡混合气中产物C的百分含量,T表示温度,p表示压强,t表示时间).下列说法正确的是( )
在体积一定的密闭容器中给定物质A、B、C的量,在一定条件下发生反应建立的化学平衡:aA(g)+bB(g)?xC(g),符合如图所示的关系(c%表示平衡混合气中产物C的百分含量,T表示温度,p表示压强,t表示时间).下列说法正确的是( )| A、此反应为吸热反应 |
| B、a+b<x |
| C、T1<T2 |
| D、P1<P2 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、普通玻璃的主要成分是纯碱、石灰石和二氧化硅 |
| B、标准状况下,1 mol Na2O2和22.4LSO2反应,转移电子数目为2NA |
| C、明矾和漂白粉常用于自来水的净化和杀菌消毒,两者的作用原理相同 |
| D、C、S分别在空气中燃烧均可得到两种不同的氧化物 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、SO2 |
| B、Na2CO3 |
| C、KMnO4 |
| D、NaClO |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、S(g)+O2(g) SO2(g)△H1; S(s)+O2(g)=SO2(g)△H2,则:△H1>△H2 |
| B、C(石墨,S)=C(金刚石,S)△H=+l.9 kJ/mol,则由石墨制取金刚石的反应是吸热反应,金刚石比石墨稳定 |
| C、NaOH(aq)+HCl(aq)=NaCl(aq)+H2O(1)△H=-57.4 kJ/mol,则:含20 gNaOH的稀溶液与稀盐酸完全反应,放出的热量为28.7 kJ |
| D、2C(s)+O2(g)=2CO(g)△H=-221kJ/mol,则碳的燃烧热等于110.5kJ/mol |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com