
| 14.35g |
| 143.5g/mol |
| 14.35g |
| 143.5g/mol |
|


科目:高中化学 来源: 题型:
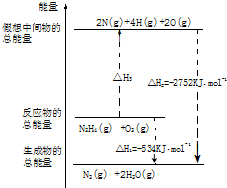 氨和肼(N2H4)是氮的两种常见化合物,在科学技术和生产中有重要的应用.
氨和肼(N2H4)是氮的两种常见化合物,在科学技术和生产中有重要的应用.查看答案和解析>>
科目:高中化学 来源: 题型:
| 反应时间/min | n(CO)/mol | n(H2O)/mol |
| 0 | 1.20 | 0.60 |
| t1 | 0.40 | |
| t2 | 0.80 |
| A、反应在t1min内的平均速率为v(H2)=(0.10/t1 )mol?L-1?min-1 |
| B、保持其他条件不变,向平衡体系中再通入0.60 molCO和1.20 molH2O,到达平衡时,c(CO2)=0.90 mol?L-1 |
| C、保持其他条件不变,向平衡体系中再通入0.20 mol H2O(g),与原平衡相比,达到新平衡时CO转化率增大 |
| D、温度升至850℃,上述反应的平衡常数变为0.85,则该反应的正反应为放热反应 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、原子半径大小顺序为:B>C>D>A |
| B、四种元素都属于非金属元素,它们之间只能形成共价化合物 |
| C、B、C元素位于元素周期表中第二周期,D元素位于元素周期表中第三周期 |
| D、BA4、CA4+两种微粒都具有正四面体结构,B、C、D三种元素都有属于分子晶体、原子晶体的同素异形体 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| 元素编号 | 元素性质或原子结构 |
| A | 第三周期中的半导体材料 |
| B | L层s电子数比p电子数少1 |
| C | 地壳中含量最高的元素 |
| D | 短周期元素第一电离能最小 |
| E | 第四周期中未成对电子数最多 |
查看答案和解析>>
科目:高中化学 来源: 题型:
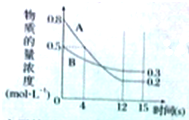 已知:反应aA(g)+bB(g)?cC(g)某温度下,在2L的密闭容器中投入一定量的A、B,两种气体的物质的量浓度随时间变化的曲线如图所示.
已知:反应aA(g)+bB(g)?cC(g)某温度下,在2L的密闭容器中投入一定量的A、B,两种气体的物质的量浓度随时间变化的曲线如图所示.查看答案和解析>>
科目:高中化学 来源: 题型:
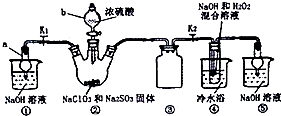 亚氯酸钠是一种高效氧化剂、漂白剂.已知饱和溶液在温度低于38℃时析出的晶体是NaClO2?3H2O,高于38℃时析出晶体是NaClO2,高于60℃时分解成NaClO3和NaCl.利用如图所示装置制备亚氯酸钠.
亚氯酸钠是一种高效氧化剂、漂白剂.已知饱和溶液在温度低于38℃时析出的晶体是NaClO2?3H2O,高于38℃时析出晶体是NaClO2,高于60℃时分解成NaClO3和NaCl.利用如图所示装置制备亚氯酸钠.查看答案和解析>>
科目:高中化学 来源: 题型:
| A、工业上用电解法获得Z、R的单质 |
| B、Y、Z、R的简单离子具有相同的电子层结构 |
| C、由X与Y、X与W形成的化合物放在空气中都易变质 |
| D、由X、Y、Z形成的化合物能与X、Y、R形成的化合物发生复分解反应 |
查看答案和解析>>
科目:高中化学 来源: 题型:
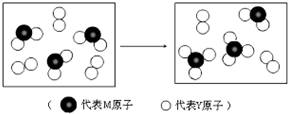 原子序数小于36的X、Y、Z、M、N、W六种元素,原子序数依次增大.已知X是迄今为止形成化合物最多的元素.Y原子最外层电子数与核外电子总数之比为3:4.M元素的常见氧化物有两种,其中一种常温下为气体,且是主要的大气污染物.Z、M、N 同周期,M2-、N-、Z+离子半径逐渐减小.W是第Ⅷ族元素中原子序数最小的元素.据此回答:
原子序数小于36的X、Y、Z、M、N、W六种元素,原子序数依次增大.已知X是迄今为止形成化合物最多的元素.Y原子最外层电子数与核外电子总数之比为3:4.M元素的常见氧化物有两种,其中一种常温下为气体,且是主要的大气污染物.Z、M、N 同周期,M2-、N-、Z+离子半径逐渐减小.W是第Ⅷ族元素中原子序数最小的元素.据此回答:查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com