
| A、工业上用电解法获得Z、R的单质 |
| B、Y、Z、R的简单离子具有相同的电子层结构 |
| C、由X与Y、X与W形成的化合物放在空气中都易变质 |
| D、由X、Y、Z形成的化合物能与X、Y、R形成的化合物发生复分解反应 |


 名校课堂系列答案
名校课堂系列答案科目:高中化学 来源: 题型:
| 元素 | 有关信息 |
| A | 最高价氧化物对应的水化物与其氢化物反应生成离子化合物 |
| B | 地壳中含量最多的元素 |
| C | 单质须保存在煤油中 |
| D | 单质与NaOH溶液反应可用于生产漂白液 |
| E | 单质是生活中用量最大的金属,其制品在潮湿空气中易被腐蚀或损坏 |
查看答案和解析>>
科目:高中化学 来源: 题型:
 于B原子的质子数,B2-的结构示意图为:
于B原子的质子数,B2-的结构示意图为: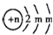
查看答案和解析>>
科目:高中化学 来源: 题型:
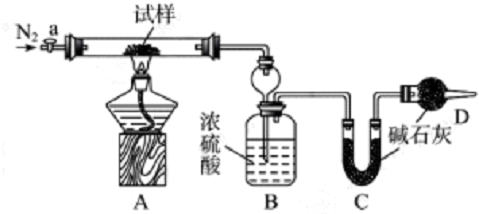
| 序号 | a | b | c | d | e |
| 数据 | m1,m2,m3 | m2,m3,m4,m5 | m1,m2,m4 | m1,m4,m5 | m1,m3,m5 |
查看答案和解析>>
科目:高中化学 来源: 题型:
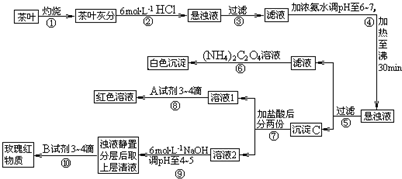
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
| 实验编号 | 氨水物质的量 浓度(mol?L-1) | 盐酸物质的量 浓度(mol?L-1) | 混合溶 液pH |
| ① | 0.1 | 0.1 | pH=5 |
| ② | c | 0.2 | pH=7 |
| ③ | 0.2 | 0.1 | pH>7 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com