
| ||
| ||
| m |
| M |
| 1000×103g |
| 478g/mol |


科目:高中化学 来源: 题型:
| A、原子半径大小顺序为:B>C>D>A |
| B、四种元素都属于非金属元素,它们之间只能形成共价化合物 |
| C、B、C元素位于元素周期表中第二周期,D元素位于元素周期表中第三周期 |
| D、BA4、CA4+两种微粒都具有正四面体结构,B、C、D三种元素都有属于分子晶体、原子晶体的同素异形体 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、工业上用电解法获得Z、R的单质 |
| B、Y、Z、R的简单离子具有相同的电子层结构 |
| C、由X与Y、X与W形成的化合物放在空气中都易变质 |
| D、由X、Y、Z形成的化合物能与X、Y、R形成的化合物发生复分解反应 |
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
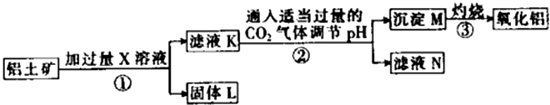
| A、X既可以是HCl,也可以是NaOH |
| B、第②步反应的离子方程式为2AlO2-+CO2+3H2O═2Al(OH)3↓+CO32- |
| C、固体L中含有Fe2O3和MgO等 |
| D、滤液N经蒸干、灼烧后可以得到纯净的Na2CO3固体 |
查看答案和解析>>
科目:高中化学 来源: 题型:
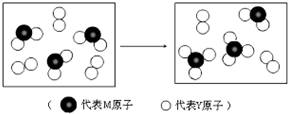 原子序数小于36的X、Y、Z、M、N、W六种元素,原子序数依次增大.已知X是迄今为止形成化合物最多的元素.Y原子最外层电子数与核外电子总数之比为3:4.M元素的常见氧化物有两种,其中一种常温下为气体,且是主要的大气污染物.Z、M、N 同周期,M2-、N-、Z+离子半径逐渐减小.W是第Ⅷ族元素中原子序数最小的元素.据此回答:
原子序数小于36的X、Y、Z、M、N、W六种元素,原子序数依次增大.已知X是迄今为止形成化合物最多的元素.Y原子最外层电子数与核外电子总数之比为3:4.M元素的常见氧化物有两种,其中一种常温下为气体,且是主要的大气污染物.Z、M、N 同周期,M2-、N-、Z+离子半径逐渐减小.W是第Ⅷ族元素中原子序数最小的元素.据此回答:查看答案和解析>>
科目:高中化学 来源: 题型:
| A、5:1 | B、1:5 |
| C、3:7 | D、7:3 |
查看答案和解析>>
科目:高中化学 来源: 题型:
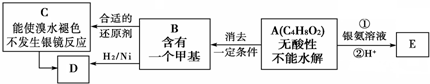
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com