
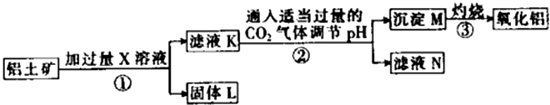
| A、X既可以是HCl,也可以是NaOH |
| B、第②步反应的离子方程式为2AlO2-+CO2+3H2O═2Al(OH)3↓+CO32- |
| C、固体L中含有Fe2O3和MgO等 |
| D、滤液N经蒸干、灼烧后可以得到纯净的Na2CO3固体 |


 怎样学好牛津英语系列答案
怎样学好牛津英语系列答案科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
| B | ||
| A | C |
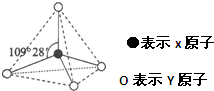
| A、A为ⅤA族元素 |
| B、B为第二周期的元素 |
| C、C是周期表中化学性质最活泼的非金属 |
| D、三种元素都为非金属元素 |
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、加热NH4HCO3至熔融状态:NH4HCO3═NH4++HCO3? |
| B、CO2通入水中得到H2CO3:H2CO3═2H++CO32? |
| C、醋酸钠溶于水:CH3COONa═CH3COO-+Na+ |
| D、C2H5OH溶于水:C2H5OH═C2H5++OH- |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com