
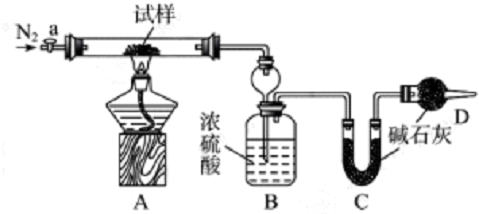
| 序号 | a | b | c | d | e |
| 数据 | m1,m2,m3 | m2,m3,m4,m5 | m1,m2,m4 | m1,m4,m5 | m1,m3,m5 |
| ||
| ||
| ||
| ||
| ||
| m1 |
| 42(m5-m3) |
| 11m1 |
| 42(m5-m3) |
| 11m1 |


 长江作业本同步练习册系列答案
长江作业本同步练习册系列答案 小天才课时作业系列答案
小天才课时作业系列答案科目:高中化学 来源: 题型:
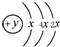 ,B、C可形成离子化合物B3C2,据此填空:
,B、C可形成离子化合物B3C2,据此填空:查看答案和解析>>
科目:高中化学 来源: 题型:
| 元素编号 | 元素性质或原子结构 |
| A | 第三周期中的半导体材料 |
| B | L层s电子数比p电子数少1 |
| C | 地壳中含量最高的元素 |
| D | 短周期元素第一电离能最小 |
| E | 第四周期中未成对电子数最多 |
查看答案和解析>>
科目:高中化学 来源: 题型:
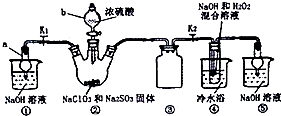 亚氯酸钠是一种高效氧化剂、漂白剂.已知饱和溶液在温度低于38℃时析出的晶体是NaClO2?3H2O,高于38℃时析出晶体是NaClO2,高于60℃时分解成NaClO3和NaCl.利用如图所示装置制备亚氯酸钠.
亚氯酸钠是一种高效氧化剂、漂白剂.已知饱和溶液在温度低于38℃时析出的晶体是NaClO2?3H2O,高于38℃时析出晶体是NaClO2,高于60℃时分解成NaClO3和NaCl.利用如图所示装置制备亚氯酸钠.查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、工业上用电解法获得Z、R的单质 |
| B、Y、Z、R的简单离子具有相同的电子层结构 |
| C、由X与Y、X与W形成的化合物放在空气中都易变质 |
| D、由X、Y、Z形成的化合物能与X、Y、R形成的化合物发生复分解反应 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、失去1mol电子 |
| B、得到1mol电子 |
| C、失去2mol电子 |
| D、没有电子得失 |
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、Si常用做信息高速公路的骨架-光导纤维的主要材料 |
| B、聚乙烯塑料的老化是由于发生了加成反应 |
| C、煤炭经气化、液化和干馏等过程,可获得清洁能源和重要的化工原料 |
| D、电解MgCl2饱和溶液,可制得金属镁 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com