
| 元素编号 | 元素性质或原子结构 |
| A | 第三周期中的半导体材料 |
| B | L层s电子数比p电子数少1 |
| C | 地壳中含量最高的元素 |
| D | 短周期元素第一电离能最小 |
| E | 第四周期中未成对电子数最多 |
 ,
, ;
;  ,B分子中含π键,在氨分子中,其中心原子氮原子的价层电子对数为
,B分子中含π键,在氨分子中,其中心原子氮原子的价层电子对数为| 5+3 |
| 2 |
 ;是;sp3;
;是;sp3;

科目:高中化学 来源: 题型:
| A、CuCl2═Cu2++Cl2- |
| B、Al2(SO4)3=2Al3++3SO42- |
| C、Fe2(SO4)3═2Fe2++3SO42- |
| D、Ba(NO3)2═Ba2++2(NO3)2- |
查看答案和解析>>
科目:高中化学 来源: 题型:
| 滴定次数 | 待测溶液的体积/mL | 标准溶液的体积 | |
| 滴定前刻度/mL | 滴定后刻度/mL | ||
| 1 | 25.00 | 1.02 | 21.03 |
| 2 | 25.00 | 2.00 | 21.99 |
| 3 | 25.00 | 0.20 | 20.20 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| 微粒代号 | a | b | c | d | e | f | g | h |
| 原子核数 | 单核 | 单核 | 双核 | 多核 | 单核 | 多核 | 多核 | 多核 |
| 微粒所 带电荷 | 0 | +1 | -1 | 0 | +2 | +1 | 0 | +1 |
查看答案和解析>>
科目:高中化学 来源: 题型:
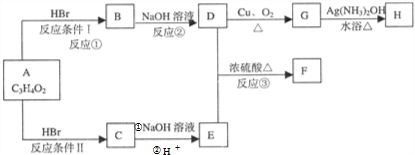
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
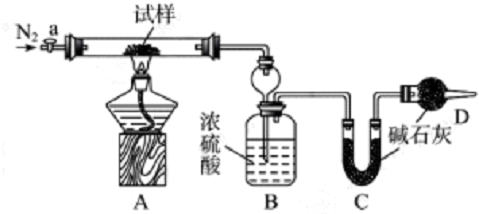
| 序号 | a | b | c | d | e |
| 数据 | m1,m2,m3 | m2,m3,m4,m5 | m1,m2,m4 | m1,m4,m5 | m1,m3,m5 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、当加入HA至溶液pH=7时,溶液中的碱还未反应完 |
| B、在滴加HA的过程中,水的电离程度先减小后增加 |
| C、在滴加HA的过程中,溶液中可能存在如下浓度关系:c(A-)>c(Na+)>c(NH4+)>c(H+)>c(OH-) |
| D、反应到达终点时:c(NH4+)+c(NH3?H2O)=0.1mol?L-1 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com