
| ||
| 1.12L |
| 22.4L/mol |
| 5.6L |
| 22.4L/mol |
| 23.4g |
| 58.5g/mol |
| ||
| 1.12L |
| 22.4L/mol |
| 5.6L |
| 22.4L/mol |
| 23.4g |
| 58.5g/mol |


科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
| 元素编号 | 元素性质或原子结构 |
| A | 第三周期中的半导体材料 |
| B | L层s电子数比p电子数少1 |
| C | 地壳中含量最高的元素 |
| D | 短周期元素第一电离能最小 |
| E | 第四周期中未成对电子数最多 |
查看答案和解析>>
科目:高中化学 来源: 题型:
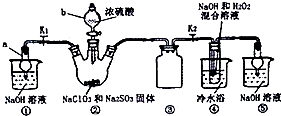 亚氯酸钠是一种高效氧化剂、漂白剂.已知饱和溶液在温度低于38℃时析出的晶体是NaClO2?3H2O,高于38℃时析出晶体是NaClO2,高于60℃时分解成NaClO3和NaCl.利用如图所示装置制备亚氯酸钠.
亚氯酸钠是一种高效氧化剂、漂白剂.已知饱和溶液在温度低于38℃时析出的晶体是NaClO2?3H2O,高于38℃时析出晶体是NaClO2,高于60℃时分解成NaClO3和NaCl.利用如图所示装置制备亚氯酸钠.查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、失去1mol电子 |
| B、得到1mol电子 |
| C、失去2mol电子 |
| D、没有电子得失 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| 甲 | 乙 | 丙 | 丁 | |
| 化合物中 各元素原 子个数比 | A:C= 1:1 | B:C= 1:2 | D:E= 1:3 | B:E= 1:4 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com