
| 滴定次数 | 待测溶液的体积/mL | 标准溶液的体积 | |
| 滴定前刻度/mL | 滴定后刻度/mL | ||
| 1 | 25.00 | 1.02 | 21.03 |
| 2 | 25.00 | 2.00 | 21.99 |
| 3 | 25.00 | 0.20 | 20.20 |


 中考解读考点精练系列答案
中考解读考点精练系列答案科目:高中化学 来源: 题型:
A、
| ||
B、
| ||
C、
| ||
D、
|
查看答案和解析>>
科目:高中化学 来源: 题型:
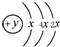 ,B、C可形成离子化合物B3C2,据此填空:
,B、C可形成离子化合物B3C2,据此填空:查看答案和解析>>
科目:高中化学 来源: 题型:
| A、上述四种元素的原子半径大小为W<X<Y<Z |
| B、W、X、Y、Z原子的核外最外层电子数的总和为17 |
| C、Z元素的最高化合价为+7价 |
| D、Y元素的最高价氧化物的对应水化物能溶解所有的金属 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| 反应时间/min | n(CO)/mol | n(H2O)/mol |
| 0 | 1.20 | 0.60 |
| t1 | 0.40 | |
| t2 | 0.80 |
| A、反应在t1min内的平均速率为v(H2)=(0.10/t1 )mol?L-1?min-1 |
| B、保持其他条件不变,向平衡体系中再通入0.60 molCO和1.20 molH2O,到达平衡时,c(CO2)=0.90 mol?L-1 |
| C、保持其他条件不变,向平衡体系中再通入0.20 mol H2O(g),与原平衡相比,达到新平衡时CO转化率增大 |
| D、温度升至850℃,上述反应的平衡常数变为0.85,则该反应的正反应为放热反应 |
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
| 元素编号 | 元素性质或原子结构 |
| A | 第三周期中的半导体材料 |
| B | L层s电子数比p电子数少1 |
| C | 地壳中含量最高的元素 |
| D | 短周期元素第一电离能最小 |
| E | 第四周期中未成对电子数最多 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、失去1mol电子 |
| B、得到1mol电子 |
| C、失去2mol电子 |
| D、没有电子得失 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com