


 黄冈360度定制密卷系列答案
黄冈360度定制密卷系列答案 阳光考场单元测试卷系列答案
阳光考场单元测试卷系列答案 名校联盟冲刺卷系列答案
名校联盟冲刺卷系列答案 名校提分一卷通系列答案
名校提分一卷通系列答案科目:高中化学 来源: 题型:
| 反应时间/min | n(CO)/mol | n(H2O)/mol |
| 0 | 1.20 | 0.60 |
| t1 | 0.40 | |
| t2 | 0.80 |
| A、反应在t1min内的平均速率为v(H2)=(0.10/t1 )mol?L-1?min-1 |
| B、保持其他条件不变,向平衡体系中再通入0.60 molCO和1.20 molH2O,到达平衡时,c(CO2)=0.90 mol?L-1 |
| C、保持其他条件不变,向平衡体系中再通入0.20 mol H2O(g),与原平衡相比,达到新平衡时CO转化率增大 |
| D、温度升至850℃,上述反应的平衡常数变为0.85,则该反应的正反应为放热反应 |
查看答案和解析>>
科目:高中化学 来源: 题型:
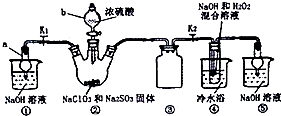 亚氯酸钠是一种高效氧化剂、漂白剂.已知饱和溶液在温度低于38℃时析出的晶体是NaClO2?3H2O,高于38℃时析出晶体是NaClO2,高于60℃时分解成NaClO3和NaCl.利用如图所示装置制备亚氯酸钠.
亚氯酸钠是一种高效氧化剂、漂白剂.已知饱和溶液在温度低于38℃时析出的晶体是NaClO2?3H2O,高于38℃时析出晶体是NaClO2,高于60℃时分解成NaClO3和NaCl.利用如图所示装置制备亚氯酸钠.查看答案和解析>>
科目:高中化学 来源: 题型:
| A、工业上用电解法获得Z、R的单质 |
| B、Y、Z、R的简单离子具有相同的电子层结构 |
| C、由X与Y、X与W形成的化合物放在空气中都易变质 |
| D、由X、Y、Z形成的化合物能与X、Y、R形成的化合物发生复分解反应 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、失去1mol电子 |
| B、得到1mol电子 |
| C、失去2mol电子 |
| D、没有电子得失 |
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
 原子序数小于36的X、Y、Z、M、N、W六种元素,原子序数依次增大.已知X是迄今为止形成化合物最多的元素.Y原子最外层电子数与核外电子总数之比为3:4.M元素的常见氧化物有两种,其中一种常温下为气体,且是主要的大气污染物.Z、M、N 同周期,M2-、N-、Z+离子半径逐渐减小.W是第Ⅷ族元素中原子序数最小的元素.据此回答:
原子序数小于36的X、Y、Z、M、N、W六种元素,原子序数依次增大.已知X是迄今为止形成化合物最多的元素.Y原子最外层电子数与核外电子总数之比为3:4.M元素的常见氧化物有两种,其中一种常温下为气体,且是主要的大气污染物.Z、M、N 同周期,M2-、N-、Z+离子半径逐渐减小.W是第Ⅷ族元素中原子序数最小的元素.据此回答:查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com