
 ,H2O2分子中H原子和O原子之间共用一对电子、O原子之间共用一对电子,所以双氧水分子结构式为H-O-O-H,
,H2O2分子中H原子和O原子之间共用一对电子、O原子之间共用一对电子,所以双氧水分子结构式为H-O-O-H, ;H-O-O-H;
;H-O-O-H;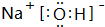 ,
,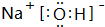 ;离子;共价键;离子;
;离子;共价键;离子;

科目:高中化学 来源: 题型:
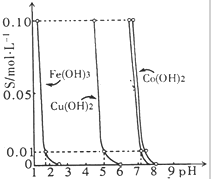 如图所示的是25℃时,Fe(OH)3、Cu(OH)2、Co(OH)2等物质在不同pH下的溶解性(c为溶液中阳离子的物质的量浓度).
如图所示的是25℃时,Fe(OH)3、Cu(OH)2、Co(OH)2等物质在不同pH下的溶解性(c为溶液中阳离子的物质的量浓度).查看答案和解析>>
科目:高中化学 来源: 题型:
| 实验编号 | 氨水物质的量 浓度(mol?L-1) | 盐酸物质的量 浓度(mol?L-1) | 混合溶 液pH |
| ① | 0.1 | 0.1 | pH=5 |
| ② | c | 0.2 | pH=7 |
| ③ | 0.2 | 0.1 | pH>7 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、原电池是把电能转化为化学能的装置 |
| B、在内电路中,电子由正极流向负极 |
| C、原电池工作时,正极表面一定有气泡产生 |
| D、原电池工作时,可能会伴随着热量变化 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、0 | B、+1 | C、+3 | D、+4 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、第17、18列都是非金属元素 |
| B、第1列元素和第17列元素的单质熔、沸点变化趋势相反 |
| C、只有第2列元素原子最外层有2个电子 |
| D、在18列元素中,第3列元素种类最多 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| 元素 | A | B | C | D |
| 性质 结构 信息 | 原子中最外层电子数为电子层数的3倍.其燃烧热为Q KJ/mol | 单质常温、常压下是气体,能溶于水.原子的M层p轨道有1个未成对的电子 | 单质质软、银白色固体、导电性强.单质在空气中燃烧发出黄色的火焰. | 原子最外层电子层上s电子数等于p电子数.单质是一种重要的半导体材料. |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com