
| 元素 | A | B | C | D |
| 性质 结构 信息 | 原子中最外层电子数为电子层数的3倍.其燃烧热为Q KJ/mol | 单质常温、常压下是气体,能溶于水.原子的M层p轨道有1个未成对的电子 | 单质质软、银白色固体、导电性强.单质在空气中燃烧发出黄色的火焰. | 原子最外层电子层上s电子数等于p电子数.单质是一种重要的半导体材料. |
| ||
| ||
| ||


 期末冲刺100分创新金卷完全试卷系列答案
期末冲刺100分创新金卷完全试卷系列答案科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
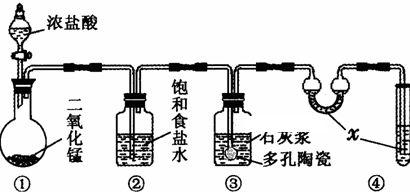
| 滴定次数 | 1 | 2 | 3 |
| KI溶液体积/mL | 19.98 | 20.02 | 20.00 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| 元素代号 | L | M | Q | R | T |
| 原子半径/nm | 0.160 | 0.143 | 0.102 | 0.089 | 0.074 |
| 主要化合价 | +2 | +3 | +6、-2 | +2 | -2 |
| A、L、M的单质与稀硫酸反应速率:M>L |
| B、T、Q的氢化物常态下均为无色气体 |
| C、R是非金属元素 |
| D、M3+是同周期简单离子中半径最小的 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| 元素 | A | B | C | D |
| 性质结构信息 | 原子核外有两个电子层,最外层有3个未成对的电子 | 原子的M层有1对成对的p电子 | 原子核外电子排布为[Ar]3d104sx,有+1、+2两种常见化合价 | 有两种常见氧化物,其中有一种是冶金工业常用的还原剂 |
查看答案和解析>>
科目:高中化学 来源: 题型:
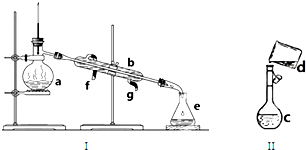
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、尼龙、羊毛和棉花都是天然纤维 |
| B、有机玻璃、锦纶、电玉、真丝巾都是合成塑料 |
| C、由酚醛树脂合成的电木,制成的插座破裂后可以热修补 |
| D、装食品用的聚乙烯塑料袋可以通过加热进行封口 |
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com