
在某K2SO4和Fe2(SO4)3的混合溶液中,Fe3+摩尔浓度为0.1摩/升,SO42-摩尔浓度为0.3摩/升,则K+的物质的量浓度为( )摩/升.
A.0.6 B.0.3 C.0.2 D.0.15
 名校课堂系列答案
名校课堂系列答案科目:高中化学 来源:2015-2016学年河北省高二上学期第一次月考化学试卷(解析版) 题型:填空题
(14分)(1)今有2H2+O2 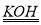 2H2O反应,构成燃料电池,则负极通入的应是 ,正极通的应是 。电极反应式为正极: ;负极: ;
2H2O反应,构成燃料电池,则负极通入的应是 ,正极通的应是 。电极反应式为正极: ;负极: ;
(2)若把KOH溶液改为稀H2SO4作电解质,则电极反应式为
正极: ;负极: ;
(1)和(2)的电解质不同,反应后,其溶液的pH各有什么变化? ;
(3)若把H2改为CH4,用KOH溶液作电解质溶液,则负极的电极反应式为 。
查看答案和解析>>
科目:高中化学 来源:2016届湖南省衡阳市高三上学期第一次月考化学试卷(解析版) 题型:填空题
工业碳酸钠(纯度约为98%)中常含有Ca2+、Mg2+、Fe3+、Clˉ和SO42ˉ等杂质,为了提纯工业碳酸钠,并获得试剂级碳酸钠的工艺流程图如下:
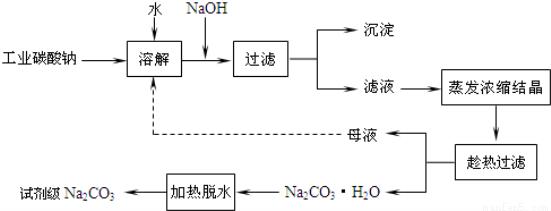
已知:碳酸钠的饱和溶液在不同温度下析出的溶质如下图所示:

 (1)加入NaOH溶液时发生的离子反应方程式为 、 。
(1)加入NaOH溶液时发生的离子反应方程式为 、 。
(2)热的Na2CO3溶液有较强的去油污能力,其原因是(用离子方程式及必要的文字加以解释) 。
(3)“趁热过滤”时的温度应控制在 。
(4)已知:Na2CO3·10 H2O(s)=Na2CO3(s)+10 H2O(g) △H=+532.36kJ·mol—1
Na2CO3·10 H2O(s)=Na2CO3·H2O(s)+9 H2O(g) △H=+473.63kJ·mol—1
写出Na2CO3·H2O脱水反应的热化学方程式 。
(5)有人从“绿色化学”角度设想将“母液”沿流程图中虚线所示进行循环使用。请你分析实际生产中是否可行 ,其理由是 。
查看答案和解析>>
科目:高中化学 来源:2016届黑龙江省双鸭山市高三上第一次月考化学试卷(解析版) 题型:选择题
在离子浓度都为0.1 mol/L下列溶液中,加入(或通入)某物质后,发生反应先后顺序正确是
A.在含Fe3+、 Cu2+、 H+的溶液中加入锌粉:Cu 2+、 Fe3+、H+
B.在含I-、SO32-、Br-的溶液中不断通入氯气:I-、Br-、SO32-
C.在含AlO2-、SO32-、OH-的溶液中逐滴加入硫酸氢钠溶液:OH-、AlO2-、SO32-
D.在含Fe 3+、 H+、NH4+ 的溶液中逐渐加入烧碱溶液:Fe3+、NH4+、H+
查看答案和解析>>
科目:高中化学 来源:2015-2016学年吉林省高一入学摸底化学试卷(解析版) 题型:计算题
一定量的氢气在氯气中燃烧,所得混合物用100mL6.00mol/L的NaOH溶液(密度为1.2g/mL)恰好完全吸收,测得溶液中含有NaClO的物质的量为0.1000mol.
(1)原NaOH溶液的质量分数为 .
(2)所得溶液中Cl﹣的物质的量为 mol.
(3)所用氯气和参加反应的氢气的物质的量之比n(Cl2):n(H2)= .
查看答案和解析>>
科目:高中化学 来源:2015-2016学年吉林省高一入学摸底化学试卷(解析版) 题型:选择题
若NA表示阿伏加德罗常数的值,下列说法正确的是
A.16g CH4与18 g NH4+ 所含质子数相等
B.0.5mol FeCl3滴入沸水可制备胶体粒子0.5 NA
C.将分子总数为NA的NH3和HCl的混合气体置于标准状况下,其体积为约22.4L
D.7.8 g Na2O2中含有的离子总数目为0.3NA
查看答案和解析>>
科目:高中化学 来源:2015-2016学年吉林省高一9月检测化学试卷(解析版) 题型:选择题
下列反应类型中一定属于氧化还原反应的是
A.化合反应 B.分解反应 C.置换反应 D.复分解反应
查看答案和解析>>
科目:高中化学 来源:2016届广东省等六校高三第一次联考化学试卷(解析版) 题型:填空题
(16分)
Ⅰ.甲学生对Cl2与FeCl2和KSCN混合溶液的反应进行实验探究。向A中通入氯气至过量,观察A中,发现溶液先呈红色,然后变为黄色。
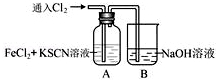
(1)B中反应的离子方程式是 .
(2)为了探究A中溶液由红色变为黄色的原因,甲同学进行如下实验.取A中黄色溶液于试管中,加入NaOH溶液,有红褐色沉淀生成,则溶液中一定存在________ .
(3)资料显示:SCN -的电子式为 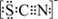 .甲同学猜想SCN﹣可能被Cl2氧化了,他进行了如下研究.
.甲同学猜想SCN﹣可能被Cl2氧化了,他进行了如下研究.
①取A中黄色溶液于试管中,加入用盐酸酸化的BaCl2溶液, 产生白色沉淀,由此证明SCN﹣中被氧化的元素是 .
②甲同学通过实验证明了SCN﹣中氮元素转化为NO3﹣,已知SCN﹣中碳元素没有被氧化,若SCN﹣与Cl2反应生成1mol CO2,则转移电子的物质的量是 mol.
Ⅱ.8.12天津港特大爆炸事故现场有700吨左右氰化钠,氰化钠剧毒。有少量因爆炸冲击发生泄漏。这些泄露的氰化钠可通过喷洒氧化剂双氧水的方式来处理,以减轻污染。
(1)写出NaCN的电子式__________,偏碱性条件下,氰化钠溶液的CN﹣被双氧水氧化为HCO3﹣,同时放出NH3,该反应的离子方程式:_______ 。
(2)Cu2+可作为双氧水氧化CN﹣中的催化剂。某兴趣小组要探究Cu2+对双氧水氧化CN﹣是否起催化作用,请你完成下实验方案。填写实验步骤、实验现象和结论(己知:CN﹣浓度可用离子色谱仪测定)
步骤:分别取等体积、等浓度的含氰废水于甲、乙两支试管中,________________________________ ___________________________________________ ___________________________________________ __________________________________________ | 现象与结论: 若____________________________ _______________________________ 若____________________________ ____________________ |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com