
【题目】著名丹麦物理学家尼·玻尔(N·Bohr)将他钟爱的金制诺贝尔奖章用王水溶解成“金溶液”,化学方程式可简单表示为:Au+HNO3+3HCl===AuCl3+NO↑+2H2O,AuCl3+HCl===HAuCl4(四氯合金酸)。纳粹分子对这种溶液“愚笨”得视而不见、毫无所知。战争结束后,物理学家又根据以下反应,炼出黄金并铸出更加灿烂夺目的奖章:2HAuCl4![]() 2HCl↑+3Cl2↑+2Au。表现出伟大科学家对祖国的无比热爱和非凡智慧。下列叙述中正确的是( )
2HCl↑+3Cl2↑+2Au。表现出伟大科学家对祖国的无比热爱和非凡智慧。下列叙述中正确的是( )
A.王水能溶解黄金,但不能溶解白金
B.HAuCl4具有很强的氧化性
C.盐酸有很强的还原性
D.浓盐酸和浓硝酸按照体积比1:3能配成王水
科目:高中化学 来源: 题型:
【题目】燃煤能排放大量的CO、CO2、SO2,PM2.5(可入肺颗粒物)污染也跟冬季燃煤密切相关。SO2、CO、CO2也是对环境影响较大的气体,对它们的合理控制、利用是优化我们生存环境的有效途径。

(1)如图所示,利用电化学原理将SO2 转化为重要化工原料C,若A为SO2,B为O2,则负极的电极反应式为:___________;
(2)有一种用CO2生产甲醇燃料的方法:CO2+3H2![]() CH3OH+H2O
CH3OH+H2O
已知:CO2(g)+3H2(g)![]() CH3OH(g)+H2O(g)△H=-a kJ·mol-1;
CH3OH(g)+H2O(g)△H=-a kJ·mol-1;
2H2(g)+O2(g)=2H2O(g)△H=-b kJ·mol-1;
H2O(g)=H2O(l)△H=-c kJ·mol-1;
CH3OH(g)=CH3OH(l)△H=-d kJ·mol-1。
则表示CH3OH(l)燃烧热的热化学方程式为:____________________________;
(3)将不同量的CO(g)和H2O(g)分别通入到体积为2L的恒容密闭容器中,进行反应CO(g)+H2O(g)![]() CO2(g)+H2(g),得到如下三组数据:
CO2(g)+H2(g),得到如下三组数据:
实验组om] | 温度℃ | 起始量/mol[ | 平衡量/mol | 达到平衡所需 时间/min | ||
CO | H2O | H2 | CO | |||
1 | 650 | 4 | 2 | 1.6 | 2.4 | 6 |
2 | 900 | 2 | 1 | 0.4 | 1.6 | 3 |
3 | 900 | a | b | c | d | t |
①实验2条件下平衡常数K=________,该反应的ΔH________0 (填“>”或“<”)。
②实验3中,若平衡时,CO的转化率大于水蒸气,则b/a 的值______(填具体值或取值范围)。
③实验4,若900℃时,在此容器中加入CO、H2O、CO2 、H2均为1mol,则此时V逆 V正(填“<” ,“>” ,“=”)。
④判断该反应达到平衡的依据是________。
A.CO2减少的化学反应速率和CO减少的化学反应速率相等 B.容器内气体压强保持不变
C.CO、H2O、CO2、H2的浓度都相等 D.容器中气体的平均相对分子质量不随时间而变化
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】X、Y、Z、W为四种短周期元素,它们在周期表中位于连续的四个主族,如图所示。Z元素原子最外层电子数是内层电子总数的1/5。下列说法中正确的是
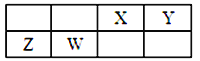
A. 原子半径由小到大的顺序为:X<Z<Y<W
B. Y元素最高价氧化物对应的水化物化学式为H3YO4
C. X、Z两种元素的氧化物中所含化学键类型相同
D. Y最简单气态氢化物比Y相邻周期同主族元素气态氢化物沸点高
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】硫化锌(ZnS)是一种重要的化工原料,难溶于水,可由炼锌的废渣锌灰制取,其工艺流程如图:

(1)为提高锌灰的浸取效率,不采用的方法是______________(填序号)
①研磨②搅拌③多次浸取④升高温度⑤加压
(2)步骤Ⅱ所得滤渣中的物质是______________(写化学式)。
(3)步骤Ⅲ中可得Cd单质,为避免引入新的杂质,试剂b应为______________。
(4)步骤Ⅳ还可以回收Na2SO4来制取Na2S。
①检验ZnS固体是否洗涤干净的方法是______________;
②Na2S可由等物质的量的Na2SO4和CH4在高温、催化剂条件下制取.化学反应方程式为______________。
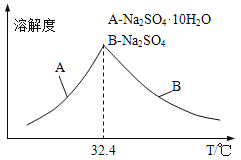
③已知Na2SO410H2O及Na2SO4的溶解度随温度变化曲线如图。从滤液中得到Na2SO410H2O的操作方法是______________。
(5)若步骤Ⅱ加入的ZnCO3为bmol,步骤Ⅲ所得Cd为dmol,最后得到VL、物质的量浓度为cmol/L的Na2SO4溶液.则理论上所用锌灰中含有锌元素的质量为______________g。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】反应Fe+H2SO4=FeSO4+H2↑的能量变化趋势,如图所示:
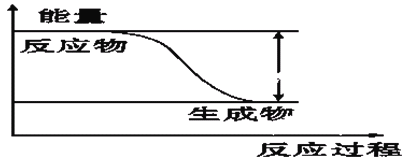
(1)该反应为 反应(填“吸热”或“放热”)。
(2)若要使该反应的反应速率加快,下列措施可行的是 (填字母)。
A.改铁片为铁粉 B.改稀硫酸为98%的浓硫酸 C.升高温度
(3)若将上述反应设计成原电池,铜为原电池某一极材料,则铜片上产生的现象为 。溶液中SO42-向 极(填“贴片”或“铜片”),外电路中电子 移动。(填“由铁片向铜片”或“由铜片向铁片”)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】可由N物质通过以下路线合成天然橡胶和香料柑青酸甲酯衍生物F。

已知:

(1)用系统命名法对N命名________.
(2)①试剂a的名称是________。②C→D中反应i的反应类型是________。
(3)E的结构简式是_____________。
(4)关于试剂b的下列说法不正确是________(填字母序号)。
a. 存在顺反异构体 b. 难溶于水c. 能发生取代、加成和氧化反应 d. 不能与NaOH溶液发生反应
(5)写出A生成B的反应方程式_________。
(6)分子中含有![]() 结构的D的所有同分异构共有________种(含顺反异构体),写出其中任意一种含反式结构的结构简式________。
结构的D的所有同分异构共有________种(含顺反异构体),写出其中任意一种含反式结构的结构简式________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】现有铁和铜组成的合金共a mol,其中铜的物质的量分数为x。将此合金研成粉末状后全部投入含b mol硝酸的稀溶液中,微热使其充分反应,硝酸的还原产物只有NO。
(1)用粒子符号填写下列空白(列举出全部可能出现的情况):

(2)当溶液中金属离子只有Fe2+、Cu2+时,则b的取值范围为 (用a、x表示)
(3)当x=0.5时,溶液中Fe3+和 Fe2+的物质的量相等,在标准状况下共生成672毫升NO气体,求a= ,b= 。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】日用牙膏的主要成分有:活性物质、摩擦剂、甘油等。假设牙膏中摩擦剂成分为CaCO3、Al(OH)3,且牙膏中其它成分不与酸、碱反应。某校化学兴趣小组利用下图所示装置(图中夹持仪器略去)进行实验,充分反应后,通过测定C中生成的BaCO3沉淀质量,以确定该牙膏中碳酸钙的质量分数。

依据实验过程回答下列问题:
(1)仪器组装完成后,密封装置A的进气口和装置D的出气口,分液漏斗中装水,打开分液漏斗的两个活塞,若_________ ,则整套装置不漏气。
(2)装置A中盛放的试剂是______,其作用是________。
(3)仪器C中选择Ba(OH)2而不选择Ca(OH)2溶液原因:__________、_________。
(4)下列各项措施中,能提高测定准确精度的是______________。(填标号)
a.在加入盐酸之前,应排净装置内的CO2气体
b.在A~B之间增添盛有浓硫酸的洗气装置
c.在B~C之间增添盛有饱和碳酸氢钠溶液的洗气装置
d.缓慢滴加稀盐酸
(5)如果没有装置D,则所测CaCO3的质量分数将_______。(选填“偏高”、“不变”或“偏低”)
(6)反应中盐酸必须过量,称量结束后,判断稀盐酸已过量的实验操作是___________ 。(写出实验步骤和现象)
(7)实验中准确称取16.00 g样品三份,进行三次测定,测得BaCO3平均质量为7.88 g,样品中碳酸钙的质量分数为 。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】一定温度下,在固定容积的密闭容器中发生下列反应∶2HI(g)![]() H2(g)+I2(g)。若HI的浓度由0.1 mol L-1 降到0.07 mol L-1时需要15s,则HI的浓度由0.07 mol L-1降到0.05 mol L-1时,所需时间为
H2(g)+I2(g)。若HI的浓度由0.1 mol L-1 降到0.07 mol L-1时需要15s,则HI的浓度由0.07 mol L-1降到0.05 mol L-1时,所需时间为
A.等于15s B.等于10 s C.大于10s D.小于10 s
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com