
【题目】一定温度下,在固定容积的密闭容器中发生下列反应∶2HI(g)![]() H2(g)+I2(g)。若HI的浓度由0.1 mol L-1 降到0.07 mol L-1时需要15s,则HI的浓度由0.07 mol L-1降到0.05 mol L-1时,所需时间为
H2(g)+I2(g)。若HI的浓度由0.1 mol L-1 降到0.07 mol L-1时需要15s,则HI的浓度由0.07 mol L-1降到0.05 mol L-1时,所需时间为
A.等于15s B.等于10 s C.大于10s D.小于10 s
科目:高中化学 来源: 题型:
【题目】著名丹麦物理学家尼·玻尔(N·Bohr)将他钟爱的金制诺贝尔奖章用王水溶解成“金溶液”,化学方程式可简单表示为:Au+HNO3+3HCl===AuCl3+NO↑+2H2O,AuCl3+HCl===HAuCl4(四氯合金酸)。纳粹分子对这种溶液“愚笨”得视而不见、毫无所知。战争结束后,物理学家又根据以下反应,炼出黄金并铸出更加灿烂夺目的奖章:2HAuCl4![]() 2HCl↑+3Cl2↑+2Au。表现出伟大科学家对祖国的无比热爱和非凡智慧。下列叙述中正确的是( )
2HCl↑+3Cl2↑+2Au。表现出伟大科学家对祖国的无比热爱和非凡智慧。下列叙述中正确的是( )
A.王水能溶解黄金,但不能溶解白金
B.HAuCl4具有很强的氧化性
C.盐酸有很强的还原性
D.浓盐酸和浓硝酸按照体积比1:3能配成王水
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】化学反应中的物质变化、能量变化、速率变化及反应的限度均是化学工作者研究的内容。
(1)对于基元反应(即反应物一步转化为生成物的反应)mA+nB![]() pC+qQ来说,其反应速率v=k正cm(A)cn(B)(可逆反应也存在类似的表达式),k为只与温度有关的速率常数;对于非基元反应(即不是一步完成的反应),则速率公式中的m、n就不一定均等于A、B的化学计量数,若某一物质对反应速率无影响,则其不会出现在上述公式中。
pC+qQ来说,其反应速率v=k正cm(A)cn(B)(可逆反应也存在类似的表达式),k为只与温度有关的速率常数;对于非基元反应(即不是一步完成的反应),则速率公式中的m、n就不一定均等于A、B的化学计量数,若某一物质对反应速率无影响,则其不会出现在上述公式中。
某科研小组测量反应“H2O2+2I+2H+![]() I2+H2O”的部分实验数据如下表所示
I2+H2O”的部分实验数据如下表所示
c(H2O2)/(mol·L1) | c(I)/(mol·L1) | c(H+)/(mol·L1) | I2的生成速率(mol·L1·s1) |
0.010 | 0.010 | 0.010 | 1.75 |
0.030 | 0.010 | 0.10 | 5.25 |
0.030 | 0.020 | 0.10 | 1.05 |
0.030 | 0.020 | 0.20 | 1.05 |
该反应的反应速率与浓度关系表达式为_________________,速率常数k=____________,该反应_______(填“是”或“不是”)基元反应。
(2)氮的氧化物是造成大气污染的主要成分之一,有多种方法消除氮氧化物的污染。下列 反应是消除污染的方法之一。
反应Ⅰ:2CO(g)+2NO(g)![]() N2(g)+2CO2(g) ΔH =746 kJ·mol1
N2(g)+2CO2(g) ΔH =746 kJ·mol1
反应Ⅱ:CO(g)+NO2(g)![]() CO2(g)+ NO(g) ΔH=227 kJ·mol1
CO2(g)+ NO(g) ΔH=227 kJ·mol1
①写出CO将NO2还原为单质的热化学方程式 。
②已知C≡O的键能为1076 kJ·mol1、C=O的键能为745 kJ·mol1,则使1 mol NO2(g)、1 mol NO(g)分解成相应的原子所需要的能量之差是___________。
(3)向某密闭容器中通入等物质的量的CO、NO,在一定条件下发生如下反应:2CO(g)+2NO(g)![]() N2(g)+2CO2(g) ΔH =746 kJ·mol1。测得反应在不同温度、压强条件下,平衡混合物中CO2的体积分数如图1所示。又知该反应的逆反应速率公式为v逆=
N2(g)+2CO2(g) ΔH =746 kJ·mol1。测得反应在不同温度、压强条件下,平衡混合物中CO2的体积分数如图1所示。又知该反应的逆反应速率公式为v逆=
k逆c2(CO2)·c(N2),实验测得平衡时v逆与c(N2)的关系如图2所示。
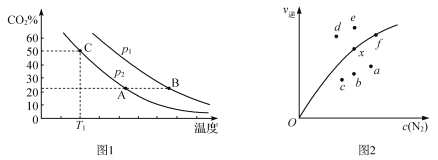
①图Ⅰ中,A、B两点对应的平衡常数K(A)_________K(B)(填“>”、“<”或“=”,下同),p1_______p2,C点所对应的反应中N2的产率是_______________。
②图Ⅱ中,当x点升高到某一温度时,反应重新达到平衡,则变为相应的点为__________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】材料是人类生存和社会进步的物质基础。
(1)铁是是现代化学工业的基础,人类进步必不可少的金属材料。工业上冶炼铁是在炼铁高炉内用一氧化碳将氧化铁还原为金属铁。已知:
① 2Fe(s)+ ![]() O2(g)=Fe2O3(s) △H=-824.6kJ/mol
O2(g)=Fe2O3(s) △H=-824.6kJ/mol
② CO(g)+![]() O2(g)= CO2(g) △H=-283.0kJ/mol
O2(g)= CO2(g) △H=-283.0kJ/mol
请写出炼铁高炉中冶铁的热化学方程式 。
(2)下图表示一定温度下,贮氢合金(M)的贮氢过程,纵轴为平衡时氢气的压强(p),横轴表示固相中氢原子与金属原子个数比(H/M)。当反应处于图中a点时,保持温度不变,向恒容体系中通入少量氢气,达到平衡后反应可能处于图中的_____点(填“b”“c”或“d”)。10g该合金2min内吸收氢气500mL,吸氢速率v=______mLg-1min-1。

(3)氮化硅是一种耐高温陶瓷材料。可用四氯化硅和氮气在氢气气氛保护下,加强热发生反应,可得较高纯度的氮化硅,反应的化学方程式为________。
(4)高氯酸铵(NH4ClO4)是用于导弹和火箭发射推进剂的新材料。传统制备NH4ClO4的方法是电解NaClO3水溶液得到NaClO4,再与NH4Cl进行复分解反应,经重结晶得到粗产品后,经多步精制、提纯得到高纯NH4ClO4。新近研究了一种制备高纯NH4ClO4的新工艺,其基本方法是用惰性电极电解高纯HClO得到高纯HClO4,再与高纯氨NH3进行喷雾反应制成高氯酸铵。
请回答下列问题:
①写出由次氯酸电解制备高氯酸的阳极电极反应式: 。
②与传统工艺相比,你认为新工艺有哪些优点: 。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】(1)下列变化属于放热反应的是______________(填序号)。
①葡萄糖在人体内被氧化成CO2;②天然气的燃烧;③煅烧大理石;④稀盐酸与稀氨水混合;⑤生石灰与水反应生成熟石灰;⑥干冰的升华;⑦钠与水反应;⑧消石灰与氯化铵晶体的反应
(2)氢气燃烧生成液态水的热化学方程式为2H2(g)+O2(g)===2H2O(l) ΔH=-572 kJ·mol-1,请回答下列问题:
①若2 mol氢气完全燃烧生成水蒸气,则放出的热量______(填“大于”、“小于”或“等于”)572 kJ。
②反应2H2+O2==2H2O的能量变化如图所示。已知拆开1 mol H2、1 mol O2和1 mol H—O中的化学键分别需要消耗436 kJ、496 kJ和463 kJ能量,则反应过程(Ⅱ)___(填“吸收”或“放出”)___kJ能量。
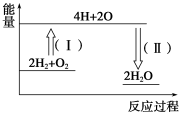
(3)已知反应2HI(g)==H2(g)+I2(g) ΔH=+11 kJ·mol-1,1 mol H2(g)、1 mol I2(g)分子中化学键断裂时分别需要吸收436 kJ、151 kJ的能量,则1 mol HI(g)分子中化学键断裂时需吸收的能量为____kJ。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下图是中学化学中常见有机物转化关系(部分相关物质和反应条件已略去)
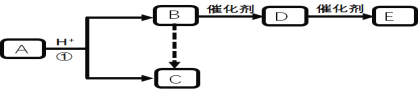
已知:Ⅰ. C的相对分子质量为60,且分子中碳元素的质量分数为40% 。
Ⅱ.B、 C、D分子含碳原子个数相同;E为高分子化合物。
回答下列问题:
(1)B中含有的官能团名称为 。
(2)E中链节为 。
(3)写出反应①的化学方程式 。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】氮是重要的非金属元素,单质用途之一是制取氨气,反应方程式为:
N2(g)+3H2(g)![]() 2NH3(g);回答下列问题:
2NH3(g);回答下列问题:
(1)氮元素在元素周期表的位置为______________,N2的结构式为______________
(2)在一个容积为2L的密闭容器中上述反应。反应开始时,各物质的量分别为:n(N2)=2mol,n(H2)=4mol,2min后n(H2)=1mol。
v表示反应速率,下列正确的是______________
A.2min末时n(NH3)=2.0molB.v(N2)=0.25mol·L-1·min-1
C.v(NH3)=1.0mol·L-1·min-1D.2min末时N2的浓度为0.5mol·L-1
(3)在350℃、30MPa下合成氨气时,n(NH3)和n(H2)(n表示物质的量)随时间变化的关系如下图所示,下列正确的是______________。
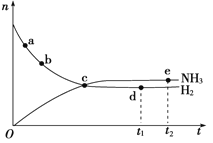
A.点a的正反应速率比点b的大
B.点c处反应达到平衡
C.点d(t1时刻)和点e(t2时刻)处n(N2)不一样
D.其他条件不变,如果加入适当催化剂可以使该反应加快
(4)氮可以形成多种离子和分子,如N3-、NH2-、N2H4、N2H5+、N2H62+等,已知N2H5+、N2H62+是中性分子N2H4结合质子生成的,有与NH4+相似的性质。
①写出N2H5+与强碱反应的离子方程式为:______________。
②在火箭推进器中装有还原剂肼(N2H4)和强氧化剂H2O2,两者反应生成两种不污染环境的物质。写出N2H4电子式______________,该反应的化学方程式为______________。
③写出与N3-电子数相等的一种分子的分子式______________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在2 L容积不变的容器中,发生N2+3H2 ![]() 2NH3的反应。现通入4 mol H2和4 mol N2,10 s内用H2表示的反应速率为0.12 mol/(L·s),则10 s后容器中N2的物质的量是
2NH3的反应。现通入4 mol H2和4 mol N2,10 s内用H2表示的反应速率为0.12 mol/(L·s),则10 s后容器中N2的物质的量是
A. 1.6 mol B. 2.8 mol
C. 3.2 mol D. 3.6 mol
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】【化学—选修3 物质结构与性质】
周期表中前四周期元素R、W、X、Y、Z的原子序数依次递增。R基态原子中,电子占据的最高能层符号为L,最高能级上只有两个自旋方向相同的电子。工业上通过分离液态空气获得X单质。Y原子的最外层电子数与电子层数之积等于R、W、X三种元素的原子序数之和。Z基态原子的最外能层只有一个电子,其他能层均已充满电子。请回答下列问题:
(1)Z2+基态核外电子排布式为________________。
(2)YX4-的空间构型是_______;与YX4-互为等电子体的一种分子为_______(填化学式);HYX4酸性比HYX2强,其原因是____________________。
(3)结构简式为RX(W2H3)2的化合物中R原子的杂化轨道类型为_______;1molRX(W2H3)2分子中含有σ键数目为_______________。
(4)往Z的硫酸盐溶液中通入过量的WH3,可生成[Z(WH3)4]SO4,下列说法正确的是_______。
A.[Z(WH3)4]SO4中所含的化学键有离子键、极性键和配位键
B.在[Z(WH3)4]2+中Z2+给出孤对电子,WH3提供空轨道
C.[Z(WH3)4]SO4组成元素中第一电离能最大的是氧元素
(5)某Y与Z形成的化合物的晶胞如图所示(黑点代表Z原子)。
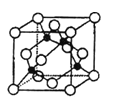
①该晶体的化学式为 。
②已知Z和Y的电负性分别为1.9和3.0,则Y与Z形成的化合物属于 (填“离子”、“共价”)化合物。
③已知该晶体的密度为ρg.cm-3,阿伏加德罗常数为NA,则该晶体中Z原子和Y原子之间的最短距离为 pm(只写计算式)。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com