
【题目】材料是人类生存和社会进步的物质基础。
(1)铁是是现代化学工业的基础,人类进步必不可少的金属材料。工业上冶炼铁是在炼铁高炉内用一氧化碳将氧化铁还原为金属铁。已知:
① 2Fe(s)+ ![]() O2(g)=Fe2O3(s) △H=-824.6kJ/mol
O2(g)=Fe2O3(s) △H=-824.6kJ/mol
② CO(g)+![]() O2(g)= CO2(g) △H=-283.0kJ/mol
O2(g)= CO2(g) △H=-283.0kJ/mol
请写出炼铁高炉中冶铁的热化学方程式 。
(2)下图表示一定温度下,贮氢合金(M)的贮氢过程,纵轴为平衡时氢气的压强(p),横轴表示固相中氢原子与金属原子个数比(H/M)。当反应处于图中a点时,保持温度不变,向恒容体系中通入少量氢气,达到平衡后反应可能处于图中的_____点(填“b”“c”或“d”)。10g该合金2min内吸收氢气500mL,吸氢速率v=______mLg-1min-1。

(3)氮化硅是一种耐高温陶瓷材料。可用四氯化硅和氮气在氢气气氛保护下,加强热发生反应,可得较高纯度的氮化硅,反应的化学方程式为________。
(4)高氯酸铵(NH4ClO4)是用于导弹和火箭发射推进剂的新材料。传统制备NH4ClO4的方法是电解NaClO3水溶液得到NaClO4,再与NH4Cl进行复分解反应,经重结晶得到粗产品后,经多步精制、提纯得到高纯NH4ClO4。新近研究了一种制备高纯NH4ClO4的新工艺,其基本方法是用惰性电极电解高纯HClO得到高纯HClO4,再与高纯氨NH3进行喷雾反应制成高氯酸铵。
请回答下列问题:
①写出由次氯酸电解制备高氯酸的阳极电极反应式: 。
②与传统工艺相比,你认为新工艺有哪些优点: 。
【答案】
(1)Fe2O3(s)+3CO(g)= 2Fe(s)+3CO2(g) △H=-24.4 kJ/mol (3分)
(2)c(2分); 25(2分)
(3)3SiCl4+2N2+6H2![]() Si3N4+12HCl (3分)
Si3N4+12HCl (3分)
(4)①阳极:HClO+3H2O-6e-→ClO4-+7H+ (2分)
② 产品纯度高、精制步骤少、生产成本低(2分)
【解析】
试题分析:
(1)方程式②×3—方程式①,即可得到方程式为Fe2O3(s) +3CO(g)= 2Fe(s) +3CO2(g)△H=-24.4 kJ/mol;
(2)由图知从A到B段压强不变表明吸氢未达到饱和,所以再通入氢气压强不会变化,处于图中曲线c点;吸氢速率v=500/10/2=25mLg-1min-1;
(3)反应物为四氯化硅和氮气,产物为氮化硅;考虑到氯元素的产物应是HCl,所以有氢气参与,方程式为3SiCl4+2N2+6H2![]() Si3N4+12HCl;
Si3N4+12HCl;
(4)电解时阳极失去电子,应是HClO失去电子生成HClO4,阳极:HClO+3H2O-6e-→ClO4-+7H+;新法中采用高纯的原料使产品纯度高、只需2步即可得到产品,所以精制步骤少、生产成本低。


 每课必练系列答案
每课必练系列答案科目:高中化学 来源: 题型:
【题目】硫化锌(ZnS)是一种重要的化工原料,难溶于水,可由炼锌的废渣锌灰制取,其工艺流程如图:

(1)为提高锌灰的浸取效率,不采用的方法是______________(填序号)
①研磨②搅拌③多次浸取④升高温度⑤加压
(2)步骤Ⅱ所得滤渣中的物质是______________(写化学式)。
(3)步骤Ⅲ中可得Cd单质,为避免引入新的杂质,试剂b应为______________。
(4)步骤Ⅳ还可以回收Na2SO4来制取Na2S。
①检验ZnS固体是否洗涤干净的方法是______________;
②Na2S可由等物质的量的Na2SO4和CH4在高温、催化剂条件下制取.化学反应方程式为______________。
③已知Na2SO410H2O及Na2SO4的溶解度随温度变化曲线如图。从滤液中得到Na2SO410H2O的操作方法是______________。
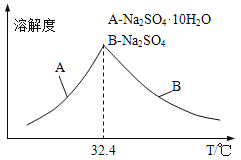
(5)若步骤Ⅱ加入的ZnCO3为bmol,步骤Ⅲ所得Cd为dmol,最后得到VL、物质的量浓度为cmol/L的Na2SO4溶液.则理论上所用锌灰中含有锌元素的质量为______________g。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】日用牙膏的主要成分有:活性物质、摩擦剂、甘油等。假设牙膏中摩擦剂成分为CaCO3、Al(OH)3,且牙膏中其它成分不与酸、碱反应。某校化学兴趣小组利用下图所示装置(图中夹持仪器略去)进行实验,充分反应后,通过测定C中生成的BaCO3沉淀质量,以确定该牙膏中碳酸钙的质量分数。

依据实验过程回答下列问题:
(1)仪器组装完成后,密封装置A的进气口和装置D的出气口,分液漏斗中装水,打开分液漏斗的两个活塞,若_________ ,则整套装置不漏气。
(2)装置A中盛放的试剂是______,其作用是________。
(3)仪器C中选择Ba(OH)2而不选择Ca(OH)2溶液原因:__________、_________。
(4)下列各项措施中,能提高测定准确精度的是______________。(填标号)
a.在加入盐酸之前,应排净装置内的CO2气体
b.在A~B之间增添盛有浓硫酸的洗气装置
c.在B~C之间增添盛有饱和碳酸氢钠溶液的洗气装置
d.缓慢滴加稀盐酸
(5)如果没有装置D,则所测CaCO3的质量分数将_______。(选填“偏高”、“不变”或“偏低”)
(6)反应中盐酸必须过量,称量结束后,判断稀盐酸已过量的实验操作是___________ 。(写出实验步骤和现象)
(7)实验中准确称取16.00 g样品三份,进行三次测定,测得BaCO3平均质量为7.88 g,样品中碳酸钙的质量分数为 。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】[化学——选修3:物质结构与性质]某绿色农药结构简式为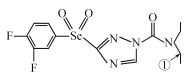 ,回答下列问题。
,回答下列问题。
(1)N元素的基态原子核外有_____种空间运动状态的电子,该农药组成元素中,第一电离能较大的前三种元素是(按由大到小顺序排列)__________________(用元素符号回答,下同),基态硒原子的价层电子排布式为________________________。
(2)该物质中杂化轨道类型为sp2的原子有__________,分子内,分子中编号为①的碳原子和与其成键另外几个原子构成的空间结构为_____________。
(3)碳、氢、氧元素可形成一系列的化合物,如CH4、C2H6、CH3OH等。三种物质的沸点高低顺序为CH4<C2H6<CH3OH,其原因是_______________________________________,三种物质中属于极性分子的物质是__________,与CH4互为等电子体的一种微粒是______。
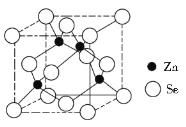
(4)硒化锌的晶胞结构如图所示,则硒的配位数为_______,若晶胞边长为d pm,设阿伏加德罗常数的值为NA,则硒化锌的密度为____________(不必化简)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】达比加群酯,是由德国公司开发的新型口服抗凝血药物,针对急性和慢性血栓栓塞性疾病的预防及治疗。F是其合成过程中的重要中间体,以下是F的合成路线图:(-Me表示甲基)

(1)写出A中含氧官能团的名称:_________和__________。
(2)B→C的反应类型是______________________。
(3)写出C→D转化的化学方程式__________________________。
(4)写出符合条件的B的同分异构体的结构简式_________________。
①属于芳香族化合物 ②能发生银镜反应 ③分子中只有两种化学环境不同的氢原子
(5)已知:![]()
肉桂酰氯![]() 是一种重要的合成中间体,试写出以苯甲醇和乙醛为原料合成该化合物的合成路线流程图(无机原料任用)。
是一种重要的合成中间体,试写出以苯甲醇和乙醛为原料合成该化合物的合成路线流程图(无机原料任用)。
合成路线流程图示例如下:
![]()
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】工业上曾经通过反应“3Fe+4NaOH![]() Fe3O4+2H2↑+4Na↑”生产金属钠。下列有关说法正确的是( )
Fe3O4+2H2↑+4Na↑”生产金属钠。下列有关说法正确的是( )
A.该反应中NaOH为还原剂
B.该反应可以在水溶液中进行
C.将生成的气态物质在空气中冷却可获得钠
D.每生成22.4L H2(标准状况),转移的电子数约为4×6.02×1023
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】一定温度下,在固定容积的密闭容器中发生下列反应∶2HI(g)![]() H2(g)+I2(g)。若HI的浓度由0.1 mol L-1 降到0.07 mol L-1时需要15s,则HI的浓度由0.07 mol L-1降到0.05 mol L-1时,所需时间为
H2(g)+I2(g)。若HI的浓度由0.1 mol L-1 降到0.07 mol L-1时需要15s,则HI的浓度由0.07 mol L-1降到0.05 mol L-1时,所需时间为
A.等于15s B.等于10 s C.大于10s D.小于10 s
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】常温下,KMnO4固体和浓盐酸反应产生氯气。为验证卤素单质氧化性的相对强弱,某小组用下图所示装置进行实验(夹持仪器已略去,气密性已检验)

实验过程:
Ⅰ.打开弹簧夹,打开活塞a,滴加浓盐酸
Ⅱ.当B和C中的溶液都变为黄色时,夹紧弹簧夹
Ⅲ.当B中溶液由黄色变为棕红色时,关闭活塞a
Ⅳ.……
(1)A中产生黄绿色气体,其电子式是___________________
(2)验证氯气的氧化性强于碘的实验现象是______________
(3)B中溶液发生反应的离子方程式是______________
(4)为验证溴的氧化性强于碘,过程Ⅳ的操作和现象是______________。
(5)过程Ⅲ实验的目的是______________
(6)氯溴碘单质的氧化性逐渐减弱的原因:同主族元素从上到下,电子层数依次增多,______________,得电子能力逐渐减弱,非金属性逐渐减弱
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】(1)实验室用电石和水反应制取乙炔
①反应的化学方程式为__________。
②下图是反应装置,其中正确的是__________。

③为了减缓反应速率,通常用__________代替水,该反应是__________反应(“放热”或者“吸热”)
④该反应产生的气体,含有杂质H2S,可用硫酸铜溶液吸收,反应的离子方程式为__________。
(2)实验室通常用浓硫酸和乙醇混合加热制取乙烯
①混合浓硫酸和乙醇的操作方法是__________。
②该实验中制取装置所用的玻璃仪器有酒精灯、导管、__________和__________;
③反应生成的乙烯中,含有多种CO2、CO2、水等多种杂质,写出浓硫酸直接将乙醇氧化生成CO2的化学方程式__________。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com