
【题目】(1)实验室用电石和水反应制取乙炔
①反应的化学方程式为__________。
②下图是反应装置,其中正确的是__________。

③为了减缓反应速率,通常用__________代替水,该反应是__________反应(“放热”或者“吸热”)
④该反应产生的气体,含有杂质H2S,可用硫酸铜溶液吸收,反应的离子方程式为__________。
(2)实验室通常用浓硫酸和乙醇混合加热制取乙烯
①混合浓硫酸和乙醇的操作方法是__________。
②该实验中制取装置所用的玻璃仪器有酒精灯、导管、__________和__________;
③反应生成的乙烯中,含有多种CO2、CO2、水等多种杂质,写出浓硫酸直接将乙醇氧化生成CO2的化学方程式__________。
【答案】(1)①CaC2+2H2O→Ca(OH)2+C2H2↑;②C;③饱和NaCl溶液;放热;④H2S+Cu2+==CuS↓+2H+
(2)①将浓硫酸沿玻璃杯慢慢注入酒精中,边加边搅拌;②温度计;烧瓶;③C2H5OH+6H2SO4(浓)→2CO2↑+6CO2↑+9H2O
【解析】
试题分析:(1)①实验室用电石和水反应制取乙炔的化学方程式为CaC2+2H2O→Ca(OH)2+C2H2↑,故答案为:CaC2+2H2O→Ca(OH)2+C2H2↑;
②电石和水反应制取乙炔是一个放热反应,不能用启普发生器,反应无需加热,为了便于控制加入水的速度,应该选用分液漏斗滴加,故选C。
③为了减缓反应速率,通常用饱和NaCl溶液代替水,该反应是放热反应,故答案为:饱和NaCl溶液;放热;
④该反应产生的气体,含有杂质H2S,可用硫酸铜溶液吸收,反应的离子方程式为H2S+Cu2+==CuS↓+2H+,故答案为:H2S+Cu2+==CuS↓+2H+;
(2)①实验室通常用浓硫酸和乙醇混合加热制取乙烯,混合浓硫酸和乙醇的操作方法是将浓硫酸沿玻璃杯慢慢注入酒精中,边加边搅拌,故答案为:将浓硫酸沿玻璃杯慢慢注入酒精中,边加边搅拌;
②该实验中制取装置所用的玻璃仪器有酒精灯、导管、温度计和烧瓶,故答案为:温度计;烧瓶;
③浓硫酸直接将乙醇氧化生成CO2的化学方程式为C2H5OH+6H2SO4(浓)→2CO2↑+6CO2↑+9H2O,故答案为:C2H5OH+6H2SO4(浓)→2CO2↑+6CO2↑+9H2O。


 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案科目:高中化学 来源: 题型:
【题目】材料是人类生存和社会进步的物质基础。
(1)铁是是现代化学工业的基础,人类进步必不可少的金属材料。工业上冶炼铁是在炼铁高炉内用一氧化碳将氧化铁还原为金属铁。已知:
① 2Fe(s)+ ![]() O2(g)=Fe2O3(s) △H=-824.6kJ/mol
O2(g)=Fe2O3(s) △H=-824.6kJ/mol
② CO(g)+![]() O2(g)= CO2(g) △H=-283.0kJ/mol
O2(g)= CO2(g) △H=-283.0kJ/mol
请写出炼铁高炉中冶铁的热化学方程式 。
(2)下图表示一定温度下,贮氢合金(M)的贮氢过程,纵轴为平衡时氢气的压强(p),横轴表示固相中氢原子与金属原子个数比(H/M)。当反应处于图中a点时,保持温度不变,向恒容体系中通入少量氢气,达到平衡后反应可能处于图中的_____点(填“b”“c”或“d”)。10g该合金2min内吸收氢气500mL,吸氢速率v=______mLg-1min-1。

(3)氮化硅是一种耐高温陶瓷材料。可用四氯化硅和氮气在氢气气氛保护下,加强热发生反应,可得较高纯度的氮化硅,反应的化学方程式为________。
(4)高氯酸铵(NH4ClO4)是用于导弹和火箭发射推进剂的新材料。传统制备NH4ClO4的方法是电解NaClO3水溶液得到NaClO4,再与NH4Cl进行复分解反应,经重结晶得到粗产品后,经多步精制、提纯得到高纯NH4ClO4。新近研究了一种制备高纯NH4ClO4的新工艺,其基本方法是用惰性电极电解高纯HClO得到高纯HClO4,再与高纯氨NH3进行喷雾反应制成高氯酸铵。
请回答下列问题:
①写出由次氯酸电解制备高氯酸的阳极电极反应式: 。
②与传统工艺相比,你认为新工艺有哪些优点: 。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在2 L容积不变的容器中,发生N2+3H2 ![]() 2NH3的反应。现通入4 mol H2和4 mol N2,10 s内用H2表示的反应速率为0.12 mol/(L·s),则10 s后容器中N2的物质的量是
2NH3的反应。现通入4 mol H2和4 mol N2,10 s内用H2表示的反应速率为0.12 mol/(L·s),则10 s后容器中N2的物质的量是
A. 1.6 mol B. 2.8 mol
C. 3.2 mol D. 3.6 mol
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】二十一世纪钛将成为铁、铝之后的第三大金属,工业上以钛铁矿为原料制备二氧化钛及钛的工艺流程如下图所示,钛铁矿的主要成分为钛酸亚铁(FeTiO3),其中一部分铁元素在风化过程中会转化为+3价,FeTiO3溶于酸后Ti元素以TiO2+存在,TiOSO4遇水可水解。
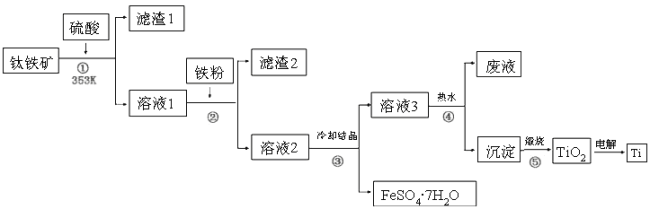
请根据以上信息回答下列问题:
(1)②中加入铁粉的目的是__________;
(2)③中混合物分离的依据是________(填字母序号)。
a.熔、沸点差异 b.溶解性差异 c.氧化性、还原性差异
(3)②、③、④中均需要进行的操作是________(填操作名称)。
(4)写出④的离子方程式:_______________;该过程在热水中操作的目的是_________
(5)利用生产过程中的废液与软锰矿(主要成分为MnO2)反应可生产硫酸锰(MnSO4,易溶于水),该反应的离子方程式为_______________。
(6)科学家从电解冶炼铝的工艺得到启发.找出了冶炼钛的新工艺。
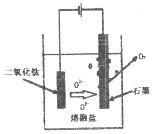
①直接电解固体TiO2法生产钛,原理如图所示,则阴极获得钛的电极反应为_____________。
②电解一段时间后,需要更换石墨电极,原因是_____________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】如图是电解CuCl2溶液的装置,其中c、d为石墨电极。

(1)正极为________(填“a”或“b”),
(2)阳极反应式为____________________,检验该阳极产物的方法是____ __
(3)电解一段时间后发现阴极增重6.4 g,则外电路中通过的电子的物质的量是________ mol。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】短周期元素A、B、C、D、E的原子序数依次增大,其元素特征信息如表:
元素编号 | 元 素 特 征 信 息 |
A | 最外层电子数是次外层电子数的2倍 |
B | 和E同主族 |
C | 1 mol C单质能与冷水反应,在标准状况下生成11.2 L H2 |
D | 原子最外层电子数等于其周期序数 |
E | 负一价阴离子的电子层结构与Ar原子相同 |
(1)D原子结构示意图为: _____ __ ,E在周期表中的位置为: 。
(2)B和C形成的化合物的电子式为: 。
(3)B和D简单离子的半径大小为: 。
(4)元素非金属性强弱比较有很多方法,其中B和E的非金属性强弱的研究方案中不可行的是: (填序号)。
A.比较两种单质的颜色 B.比较两种单质与H2化合的难易程度
C.依据两元素在周期表中的位置 D.比较对应阴离子的还原性
e.比较最高价氧化物对应水化物的酸性
(5)E元素能与另外四种元素中的一种元素形成共价化合物,分子中的原子个数比1∶4,相对分子质量为154,则该物质的化学式为: 。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】【化学—选修3 物质结构与性质】
周期表中前四周期元素R、W、X、Y、Z的原子序数依次递增。R基态原子中,电子占据的最高能层符号为L,最高能级上只有两个自旋方向相同的电子。工业上通过分离液态空气获得X单质。Y原子的最外层电子数与电子层数之积等于R、W、X三种元素的原子序数之和。Z基态原子的最外能层只有一个电子,其他能层均已充满电子。请回答下列问题:
(1)Z2+基态核外电子排布式为________________。
(2)YX4-的空间构型是_______;与YX4-互为等电子体的一种分子为_______(填化学式);HYX4酸性比HYX2强,其原因是____________________。
(3)结构简式为RX(W2H3)2的化合物中R原子的杂化轨道类型为_______;1molRX(W2H3)2分子中含有σ键数目为_______________。
(4)往Z的硫酸盐溶液中通入过量的WH3,可生成[Z(WH3)4]SO4,下列说法正确的是_______。
A.[Z(WH3)4]SO4中所含的化学键有离子键、极性键和配位键
B.在[Z(WH3)4]2+中Z2+给出孤对电子,WH3提供空轨道
C.[Z(WH3)4]SO4组成元素中第一电离能最大的是氧元素
(5)某Y与Z形成的化合物的晶胞如图所示(黑点代表Z原子)。
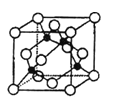
①该晶体的化学式为 。
②已知Z和Y的电负性分别为1.9和3.0,则Y与Z形成的化合物属于 (填“离子”、“共价”)化合物。
③已知该晶体的密度为ρg.cm-3,阿伏加德罗常数为NA,则该晶体中Z原子和Y原子之间的最短距离为 pm(只写计算式)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某化学兴趣小组为探究元素性质的递变规律,设计可如下系列实验。
Ⅰ、(1)将钠、钾、镁、铝各1 mol分别投入到足量的0.1 mol·L-1的盐酸中,写出与盐酸反应最慢的金属发生反应的离子方程式___________________________________。
(2)将NaOH溶液与NH4Cl溶液混合生成NH3·H2O,从而验证NaOH的碱性大于NH3·H2O,继而可以验证Na的金属性大于N,你认为此设计是否合理?并说明理由:________________________________。
Ⅱ、利用下图装置可以验证非金属性的变化规律。
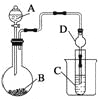 (加热及夹持仪器省略)
(加热及夹持仪器省略)
(3)实验室中提供药品浓硫酸、浓盐酸、Na2S、Na2SiO3、MnO2、CaCO3,若要证明非金属性Cl>S;装置A、B、C中所装药品分别为_________________________________,装置C中的实验现象为有淡黄色沉淀生成,离子方程式为_____________________________________。
(4)若要证明非金属性:S>C>Si,则A中加_________,B中加Na2CO3,C中加_________ ,则观察装置C中的实验现象为有白色沉淀生成。离子方程式为________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】氮化硅硬度大、熔点高、不溶于酸(氢氟酸除外),是一种重要的结构陶瓷材料。一种用工业硅(含少量钾、钠、铁、铜的氧化物),已知硅的熔点是1420℃,高温下氧气及水蒸气能明显腐蚀氮化硅。一种合成氮化硅的工艺流程如下:
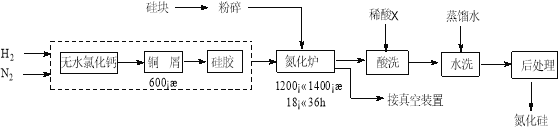
(1)净化N2和H2时,铜屑的作用是: ;硅胶的作用是 。
(2)在氮化炉中3SiO2(s)+2N2(g)=Si3N4(s) △H=-727.5kJ/mol,开始时为什么要严格控制氮气的流速以控制温度: ;体系中要通入适量的氢气是为了 。
(3)X可能是 (选填:“盐酸”、“硝酸”、“硫酸”、“氢氟酸”)。
(4)如何说明氮化硅产品已用水洗干净? 。
(5)用硅粉作硅源、叠氮化钠(NaN3)作氮源,直接燃烧生成氮化硅(发生置换反应),该反应的化学方程式为: 。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com