
【题目】如图是电解CuCl2溶液的装置,其中c、d为石墨电极。

(1)正极为________(填“a”或“b”),
(2)阳极反应式为____________________,检验该阳极产物的方法是____ __
(3)电解一段时间后发现阴极增重6.4 g,则外电路中通过的电子的物质的量是________ mol。
【答案】(1)a (2)2Cl--2e-===Cl2 ↑ 用湿润的淀粉碘化钾试纸放在该电极附近,试纸变蓝 (3)0.2
【解析】
试题分析:根据图中所给电流的方向,可知,a为直流电源的正极,b为直流电源的负极,则c为电解池的阳极,发生失去电子的氧化反应,电极反应式为:2Cl--2e-===Cl2 ↑;d为电解池的阴极,发生得到电子的还原反应,电极反应式为:Cu2++2e-===Cu。据此分析回答问题。
(1)a为直流电源的正极;
(2)阳极上Cl-失去电子生成Cl2,阳极反应式为:2Cl--2e-===Cl2 ↑;检验Cl2的方法是用湿润的淀粉碘化钾试纸放在该电极附近,试纸变蓝;
(3)电解一段时间后发现阴极增重6.4 g,则生成Cu的物质的量为:![]() ,由于阴极发生反应Cu2++2e-===Cu,因此外电路中通过电子的物质的量为n(e-)=2n(Cu)=0.2mol。
,由于阴极发生反应Cu2++2e-===Cu,因此外电路中通过电子的物质的量为n(e-)=2n(Cu)=0.2mol。


科目:高中化学 来源: 题型:
【题目】达比加群酯,是由德国公司开发的新型口服抗凝血药物,针对急性和慢性血栓栓塞性疾病的预防及治疗。F是其合成过程中的重要中间体,以下是F的合成路线图:(-Me表示甲基)

(1)写出A中含氧官能团的名称:_________和__________。
(2)B→C的反应类型是______________________。
(3)写出C→D转化的化学方程式__________________________。
(4)写出符合条件的B的同分异构体的结构简式_________________。
①属于芳香族化合物 ②能发生银镜反应 ③分子中只有两种化学环境不同的氢原子
(5)已知:![]()
肉桂酰氯![]() 是一种重要的合成中间体,试写出以苯甲醇和乙醛为原料合成该化合物的合成路线流程图(无机原料任用)。
是一种重要的合成中间体,试写出以苯甲醇和乙醛为原料合成该化合物的合成路线流程图(无机原料任用)。
合成路线流程图示例如下:
![]()
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】氢氧燃料电池是符合绿色化学理念的新型电池。电池装置如图所示,该电池电极表面镀一层细小的铂粉,铂吸附气体的能力强,性质稳定。

请回答下列问题:
(1)氢氧燃料电池的能量转化主要形式是________,在导线中电子流动方向为________(用a、b表示)。
(2)负极反应式为__________________________________________________________。
(3)电极表面镀铂粉的原因是_____________________________________________。
(4)该电池工作时,H2和O2连续由外部供给,电池可连续不断地提供电能。因此大量安全储氢是关键技术之一。金属锂是一种重要的储氢材料,吸氢和放氢原理如下:
Ⅰ.2Li+H2![]() 2LiH
2LiH
Ⅱ.LiH+H2O===LiOH+H2↑
①反应Ⅰ中的还原剂是____________,反应Ⅱ中的氧化剂是____________。
②已知LiH固体密度为0.82 g/cm3。用锂吸收224 L(标准状况)H2,生成的LiH体积与被吸收的H2体积之比为________。
③由②生成的LiH与H2O作用,放出的H2用作电池燃料,若能量转化率为80%,则导线中通过电子的物质的量为________ mol。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】自然界中金属硫化物之间存在原电池反应。下图所示装置中电极Ⅰ为方铅矿(PbS),电极Ⅱ为含有方铅矿的硫铁矿,当有电解质溶液按如图所示方向流经该装置时,电流表指针偏转。若电极Ⅱ质量不断减少,a处溶液中加入KSCN溶液未出现红色,加入CuSO4溶液未出现黑色沉淀。下列有关说法中正确的是( )

A.工业上利用该原理富集铁
B.电极Ⅱ作正极
C.溶液流经该装置后pH增大
D.该装置负极的电极反应为FeS2—15e—+8H2O=Fe3++2SO42—+16H+
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】a、b、c、d、e五种短周期元素的原子序数逐渐增大。a为非金属元素,且a、e同主族,c、d为同周期的相邻元素。e原子的质子数等于c、d原子最外层电子数之和。b原子最外层电子数是内层电子数的2倍。c的气态氢化物分子中有3个共价键。试推断:
(1)写出b元素在周期表中的位置 ;
(2)写出一种由a、c、d所形成的离子化合物 (化学式),它与e的最高价氧化物对应水化物的溶液加热时反应的离子方程式是 ;
(3)c的单质的电子式为 。
(4)b的最简单气态氢化物的结构式是
(5)b和d相比,非金属性较强的是 (用元素符号表示),下列事实能证明这一结论的是 (选填字母序号)。
A.常温下,b的单质呈固态,d的单质呈气态 |
B.d的氢化物的稳定性强于b的氢化物 |
C.b与d形成的化合物中,b呈正价 |
D.d的氢化物的沸点高于b的氢化物 |
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】(1)实验室用电石和水反应制取乙炔
①反应的化学方程式为__________。
②下图是反应装置,其中正确的是__________。

③为了减缓反应速率,通常用__________代替水,该反应是__________反应(“放热”或者“吸热”)
④该反应产生的气体,含有杂质H2S,可用硫酸铜溶液吸收,反应的离子方程式为__________。
(2)实验室通常用浓硫酸和乙醇混合加热制取乙烯
①混合浓硫酸和乙醇的操作方法是__________。
②该实验中制取装置所用的玻璃仪器有酒精灯、导管、__________和__________;
③反应生成的乙烯中,含有多种CO2、CO2、水等多种杂质,写出浓硫酸直接将乙醇氧化生成CO2的化学方程式__________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】硫化锌 (ZnS)是一种重要的化工原料,难溶于水,可由炼锌的废渣锌灰制取,其工艺流程如下图所示。

(1)为提高锌灰的浸取率,可采用的方法是 (填序号)。
①研磨 ②多次浸取 ③升高温度 ④加压 ⑤搅拌
(2)步骤Ⅱ所得滤渣中的物质是 (写化学式)。
(3)步骤Ⅲ中可得Cd单质,为避免引入新的杂质,试剂b应为____________。
(4)步骤Ⅳ还可以回收Na2SO4来制取Na2S。
①检验ZnS固体是否洗涤干净的方法是 ;
②Na2S可由等物质的量的Na2SO4和CH4在高温、催化剂条件下制取。化学反应方程式为________;
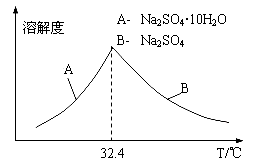
③已知Na2SO4·10H2O及Na2SO4的溶解度随温度变化曲线如图。从滤液中得到Na2SO4·10H2O的操作方法是 。
(5)若步骤Ⅱ加入的ZnCO3为b mol,步骤Ⅲ所得Cd为d mol,最后得到VL、物质的量浓度为c mol/L的Na2SO4溶液。则理论上所用锌灰中含有锌元素的质量为____________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】【化学—-选修2:化学与技术】
甘氨酸亚铁络合物[化学式为(NH2CH2COO)2Fe]是常用的补铁剂,其合成方法如下:
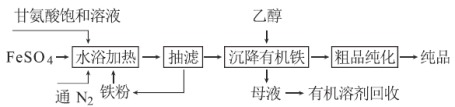
(1)通入N2的作用是 。
(2)已知甘氨酸显弱酸性,其结构简式为NH2CH2COOH,甘氨酸亚铁络合物易溶于水且在水中难电离,写出“水浴加热”过程中生成甘氨酸亚铁络合物的反应的离子方程式 。
(3)抽滤的好处是 ,从“母液”中回收有机溶剂的方法是 。
(4)“粗品纯化”的操作为蒸馏水洗涤、 洗涤、干燥,其中干燥过程使用的设备最好选用 (填“常压干燥机”或“真空干燥机”)。
(5)有文献指出,若在“水浴加热”过程中投入适量的石灰石,则能同时提高产品的产率和纯度,请解释原因: 。
(6)若甘氨酸的投料量为300 kg,产出纯品346.8 kg,则产率为 。(甘氨酸的相对分子质量为75)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】【化学——选修5:有机化学基础】奥沙拉秦是种抗菌药。其合成路线如下:

已知:①NaNO2具有强氧化性
 ②
②
(1)水杨酸中所含官能团的名称是___________。
(2)A的分子式是___________。
(3)B→C的化学方程式___________。
(4)整个合成路线看,设计B→C步骤的作用是___________。
(5)D的结构简式是___________。D→E的反应类型是___________。
(6)有机物G(结构简式见右上图)也可用于合成奥沙拉秦。它的一种同分异构体X是α-氨基酸,能与FeCl3溶液发生显色反应,这样的结构有_____种,写出一种X可能的结构简式________。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com