
【题目】氢氧燃料电池是符合绿色化学理念的新型电池。电池装置如图所示,该电池电极表面镀一层细小的铂粉,铂吸附气体的能力强,性质稳定。

请回答下列问题:
(1)氢氧燃料电池的能量转化主要形式是________,在导线中电子流动方向为________(用a、b表示)。
(2)负极反应式为__________________________________________________________。
(3)电极表面镀铂粉的原因是_____________________________________________。
(4)该电池工作时,H2和O2连续由外部供给,电池可连续不断地提供电能。因此大量安全储氢是关键技术之一。金属锂是一种重要的储氢材料,吸氢和放氢原理如下:
Ⅰ.2Li+H2![]() 2LiH
2LiH
Ⅱ.LiH+H2O===LiOH+H2↑
①反应Ⅰ中的还原剂是____________,反应Ⅱ中的氧化剂是____________。
②已知LiH固体密度为0.82 g/cm3。用锂吸收224 L(标准状况)H2,生成的LiH体积与被吸收的H2体积之比为________。
③由②生成的LiH与H2O作用,放出的H2用作电池燃料,若能量转化率为80%,则导线中通过电子的物质的量为________ mol。
【答案】 (1)由化学能转变为电能 由a到b(2)2H2+4OH--4e-===4H2O(或H2+2OH--2e-===2H2O)
(3)增大电极单位面积吸附H2、O2的分子数,加快电极反应速率(4)①Li H2O ②8.7×10-4 ③32
【解析】
试题分析:
(1)该题目中,氢氧燃料电池的工作原理属于原电池原理,是将化学能转化为电能的装置,燃料电池中,通入燃料的电极是负极、通入氧化剂的电极是正极,所以通入氢气的电极是负极,通入氧气的电极是正极,电子从负极沿导线流向正极,则电子流向由a到b,故答案为:由a到b;
(2)碱性条件下,氢气失电子和氢氧根离子反应生成水,电极反应式为:H2+2OH--2e-=2H2O,故答案为:H2+2OH--2e-=2H2O;
(3)反应物接触面积越大,其反应速率越快,在电极表面镀铂粉,增大电极单位面积吸附氢气、氧气分子数,加快反应速率,同时也增大了Pt的利用率以降低成本,故答案为:大电极单位面积吸附氢气、氧气分子数,加快反应速率,同时也增大了Pt的利用率以降低成本;
(4)①Li从零价升至+1价,作还原剂,H2O的H从+1降至H2中的零价,作氧化剂,故答案为:Li;H2O;②由反应Ⅰ,当吸收10mol H2时,则生成20mol LiH,V===197.5×10-3L,==8.82×10-4,故答案为:8.82×10-4;③20molLiH可生成20molH2,实际参加反应的H2为20mol×80%=16mol,1molH2转化成1molH2O,转移2mol电子,所以16molH2可转移32mol的电子,故答案为:32mol。


 天天向上一本好卷系列答案
天天向上一本好卷系列答案科目:高中化学 来源: 题型:
【题目】【化学—选修3物质结构与性质】已知A、B、C、D、E都是周期表中前四周期的元素,它们的原子序数依次增大。其中A元素原子的核外p电子数比s电子数少1。C是电负性最大的元素。D原子次外层电子数是最外层电子数2倍,E是第Ⅷ族中原子序数最小的元素。
(1)写出基态C原子的电子排布式 。
(2)A、B两种元素的第一电离能由大到小的顺序为____ (用元素符号表示),原因是 。
(3)已知DC4常温下为气体,则该物质的晶体类型是 ,组成微粒的中心原子的轨道杂化类型为 ,空间构型是 。
(4)Cu2+容易与AH3形成配离子[Cu(AH3)4]2+,但AC3不易与Cu2+形成配离子,其原因是 。
(5)A、B两元素分别与D形成的共价键中,极性较强的是 。A、B两元素间能形成多种二元化合物,其中与A3—互为等电子体的物质的化学式为 。
(6)已知E单质的晶胞如图所示,则晶体中E原子的配位数为 ,一个E的晶胞质量为 。

查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】(1)下列变化属于放热反应的是______________(填序号)。
①葡萄糖在人体内被氧化成CO2;②天然气的燃烧;③煅烧大理石;④稀盐酸与稀氨水混合;⑤生石灰与水反应生成熟石灰;⑥干冰的升华;⑦钠与水反应;⑧消石灰与氯化铵晶体的反应
(2)氢气燃烧生成液态水的热化学方程式为2H2(g)+O2(g)===2H2O(l) ΔH=-572 kJ·mol-1,请回答下列问题:
①若2 mol氢气完全燃烧生成水蒸气,则放出的热量______(填“大于”、“小于”或“等于”)572 kJ。
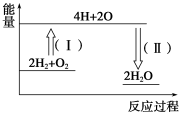
②反应2H2+O2==2H2O的能量变化如图所示。已知拆开1 mol H2、1 mol O2和1 mol H—O中的化学键分别需要消耗436 kJ、496 kJ和463 kJ能量,则反应过程(Ⅱ)___(填“吸收”或“放出”)___kJ能量。
(3)已知反应2HI(g)==H2(g)+I2(g) ΔH=+11 kJ·mol-1,1 mol H2(g)、1 mol I2(g)分子中化学键断裂时分别需要吸收436 kJ、151 kJ的能量,则1 mol HI(g)分子中化学键断裂时需吸收的能量为____kJ。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】氮是重要的非金属元素,单质用途之一是制取氨气,反应方程式为:
N2(g)+3H2(g)![]() 2NH3(g);回答下列问题:
2NH3(g);回答下列问题:
(1)氮元素在元素周期表的位置为______________,N2的结构式为______________
(2)在一个容积为2L的密闭容器中上述反应。反应开始时,各物质的量分别为:n(N2)=2mol,n(H2)=4mol,2min后n(H2)=1mol。
v表示反应速率,下列正确的是______________
A.2min末时n(NH3)=2.0molB.v(N2)=0.25mol·L-1·min-1
C.v(NH3)=1.0mol·L-1·min-1D.2min末时N2的浓度为0.5mol·L-1
(3)在350℃、30MPa下合成氨气时,n(NH3)和n(H2)(n表示物质的量)随时间变化的关系如下图所示,下列正确的是______________。
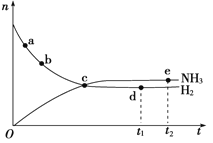
A.点a的正反应速率比点b的大
B.点c处反应达到平衡
C.点d(t1时刻)和点e(t2时刻)处n(N2)不一样
D.其他条件不变,如果加入适当催化剂可以使该反应加快
(4)氮可以形成多种离子和分子,如N3-、NH2-、N2H4、N2H5+、N2H62+等,已知N2H5+、N2H62+是中性分子N2H4结合质子生成的,有与NH4+相似的性质。
①写出N2H5+与强碱反应的离子方程式为:______________。
②在火箭推进器中装有还原剂肼(N2H4)和强氧化剂H2O2,两者反应生成两种不污染环境的物质。写出N2H4电子式______________,该反应的化学方程式为______________。
③写出与N3-电子数相等的一种分子的分子式______________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】【化学—选修3:物质结构】前四周期原子序数依次增大的六种元素,A、B、C、D、E、H中,A元素在宇宙中含量最丰富,B元素基态原子的核外有3种能量不同的原子轨道,且每种轨道中的电子数目相同。D元素是地壳中含量最多的元素,E为d区元素,其外围电子排布中有4对成对电子,H元素基态原子最外层只有一个电子,其它层均已充满电子。
(1)E元素在周期表中的位置是 。
(2)六种元素中电负性最大的元素为 ,前五种元素中第一电离能最小的元素为______(写元素符号)。C元素与元素氟能形成C2F2分子,该分子中C原子的杂化方式是____________。
(3)配合物E(BD)4常温下为液态,易溶于CCl4、苯等有机溶剂,据此判断该分子属于 分子(填“极性”或“非极性”)。该分子中σ键与π键数目比为 。
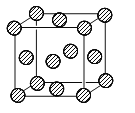
(4)H单质的晶胞结构如图所示,则原子采取的堆积方式为 ,若已知H原子半径为r pm ,NA表示阿伏伽德罗常数,摩尔质量为M,用相应字母表示:
①该原子的配位数为 。
②该晶体的密度为 g/cm3。
③H原子采取这种堆积方式的空间利用率为 (用含π表达式表示)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在2 L容积不变的容器中,发生N2+3H2 ![]() 2NH3的反应。现通入4 mol H2和4 mol N2,10 s内用H2表示的反应速率为0.12 mol/(L·s),则10 s后容器中N2的物质的量是
2NH3的反应。现通入4 mol H2和4 mol N2,10 s内用H2表示的反应速率为0.12 mol/(L·s),则10 s后容器中N2的物质的量是
A. 1.6 mol B. 2.8 mol
C. 3.2 mol D. 3.6 mol
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】锂—铜空气燃料电池容量高、成本低,具有广阔的发展前景。该电池通过一种复杂的铜腐蚀“现象”产生电能,其中放电过程为2Li+Cu2O+H2O=2Cu+2Li++2OH-,下列说法不正确的是

A.放电时,Li+透过固体电解质向Cu极移动
B.放电时,正极的电极反应式为O2+2H2O+4e-=4OH-
C.通空气时,铜被腐蚀,表面产生Cu2O
D.整个反应过程中,氧化剂为O2
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】如图是电解CuCl2溶液的装置,其中c、d为石墨电极。

(1)正极为________(填“a”或“b”),
(2)阳极反应式为____________________,检验该阳极产物的方法是____ __
(3)电解一段时间后发现阴极增重6.4 g,则外电路中通过的电子的物质的量是________ mol。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】用以下三种途径来制取等质量的硝酸铜。
①铜与稀硝酸反应;
②铜与浓硝酸反应;
③铜先与氧气反应生成氧化铜,氧化铜再跟硝酸反应。以下叙述不正确的是
A.三种途径所消耗铜的质量相等
B.三种途径所消耗硝酸的物质的量是①>②>③
C.途径③的制备方法最符合“绿色化学”理念
D.途径①中被氧化的铜与被还原的硝酸的物质的量之比是3:2
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com