
【题目】【化学—选修3物质结构与性质】已知A、B、C、D、E都是周期表中前四周期的元素,它们的原子序数依次增大。其中A元素原子的核外p电子数比s电子数少1。C是电负性最大的元素。D原子次外层电子数是最外层电子数2倍,E是第Ⅷ族中原子序数最小的元素。
(1)写出基态C原子的电子排布式 。
(2)A、B两种元素的第一电离能由大到小的顺序为____ (用元素符号表示),原因是 。
(3)已知DC4常温下为气体,则该物质的晶体类型是 ,组成微粒的中心原子的轨道杂化类型为 ,空间构型是 。
(4)Cu2+容易与AH3形成配离子[Cu(AH3)4]2+,但AC3不易与Cu2+形成配离子,其原因是 。
(5)A、B两元素分别与D形成的共价键中,极性较强的是 。A、B两元素间能形成多种二元化合物,其中与A3—互为等电子体的物质的化学式为 。
(6)已知E单质的晶胞如图所示,则晶体中E原子的配位数为 ,一个E的晶胞质量为 。

【答案】
(1)1s22s22p5(2分)
(2)N>O(1分) N原子的2p能级处于较稳定的半充满状态(2分)
(3)分子晶体(1分) sp3(1分) 正四面体形(1分)
(4)由于电负性F>N>H,在NF3分子中,共用电子对偏向F原子,使得N原子上的孤电子对难与Cu2+形成配位键(2分)
(5)Si-O键(1分) N2O(1分)
(6)8(1分) ![]() (2分)
(2分)
【解析】
试题分析:A、B、C、D、E都是周期表中前四周期的元素,它们的原子序数依次增大。A元素原子的核外p电子数比s电子数少1,则A元素的核外电子排布为1s22s22p3,不可能为1s22s22p53s2,因此A为N元素。C是电负性最大的元素,所以C是F,则B是O。D原子次外层电子数是最外层电子数2倍,则D为Si元素。E是第Ⅷ族中原子序数最小的元素,E为Fe元素。
(1)C为F元素,原子序数为9,基态原子的电子排布式为1s22s22p5;
(2)N原子的2p能级处于较稳定的半充满状态,所以第一电离能大于氧元素;
(3)根据SiF4常温下为气体,该物质在固态时构成分子晶体,组成微粒的中心原子Si与4个F原子相连,没有孤电子对,采用sp3杂化,空间构型是正四面体形;
(4)氨易于与Cu2+形成配离子,而NF3难与Cu2+形成配离子,由于电负性F>N>H,在NF3分子中,共用电子对偏向F原子,使得N原子上的孤电子对难与Cu2+形成配位键;
(5)O的非金属性较强,吸引电子的能力大于N,极性较强的是Si-O键,A、B两元素间能形成多种二元化合物,其中与N3—互为等电子体的物质的化学式为N2O;
(6)根据铁单质的晶胞示意图,晶胞为体心立方,体心的铁原子到8个顶点的距离相等且最短,铁原子的配位数为8,一个铁的晶胞中含有铁原子的数目为1+8×![]() =2,1mol晶胞的质量为112g,一个晶胞的质量为
=2,1mol晶胞的质量为112g,一个晶胞的质量为![]() 。
。


科目:高中化学 来源: 题型:
【题目】下列关于电解质溶液的说法错误的是
A.pH=3的 NH4Cl溶液与pH=3的盐酸中,水电离的c(H+)相等
B.25℃时将0.1mol·L -1 的HF加水不断稀释,![]() 不变
不变
C.K2SO3溶液中加入少量NaOH固体,溶液的pH增大,SO32-水解程度减小
D.pH=5的CH3 COOH 与CH3COONa混合溶液中,c(CH3COO-)<c(Na+)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】反应Fe+H2SO4=FeSO4+H2↑的能量变化趋势,如图所示:
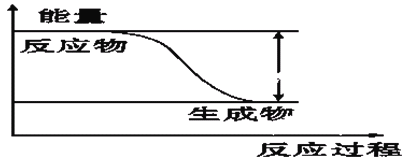
(1)该反应为 反应(填“吸热”或“放热”)。
(2)若要使该反应的反应速率加快,下列措施可行的是 (填字母)。
A.改铁片为铁粉 B.改稀硫酸为98%的浓硫酸 C.升高温度
(3)若将上述反应设计成原电池,铜为原电池某一极材料,则铜片上产生的现象为 。溶液中SO42-向 极(填“贴片”或“铜片”),外电路中电子 移动。(填“由铁片向铜片”或“由铜片向铁片”)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】现有铁和铜组成的合金共a mol,其中铜的物质的量分数为x。将此合金研成粉末状后全部投入含b mol硝酸的稀溶液中,微热使其充分反应,硝酸的还原产物只有NO。
(1)用粒子符号填写下列空白(列举出全部可能出现的情况):

(2)当溶液中金属离子只有Fe2+、Cu2+时,则b的取值范围为 (用a、x表示)
(3)当x=0.5时,溶液中Fe3+和 Fe2+的物质的量相等,在标准状况下共生成672毫升NO气体,求a= ,b= 。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】【化学—选修5:有机化学基础】人工合成有机化合物H的路线可简单表示如下:
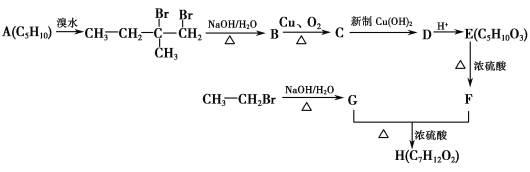
已知:F的核磁共振氢谱有四个峰,峰的面积比为1∶1∶3∶3。
请回答下列问题:
(1)A的名称(系统命名)为________;C中官能团的结构简式为_______________________。
(2)G+F―→H的反应类型为________;H的结构简式为________。
(3)C―→D的离子方程式为___________________________________________ 。
(4)E在一定条件下生成的高分子化合物的结构简式为________________________________。
(5)X是F的同分异构体,它同时符合下列3个条件:①能发生水解反应;②不含甲基;
③能发生银镜反应。则X可能的结构简式为_____________________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】日用牙膏的主要成分有:活性物质、摩擦剂、甘油等。假设牙膏中摩擦剂成分为CaCO3、Al(OH)3,且牙膏中其它成分不与酸、碱反应。某校化学兴趣小组利用下图所示装置(图中夹持仪器略去)进行实验,充分反应后,通过测定C中生成的BaCO3沉淀质量,以确定该牙膏中碳酸钙的质量分数。

依据实验过程回答下列问题:
(1)仪器组装完成后,密封装置A的进气口和装置D的出气口,分液漏斗中装水,打开分液漏斗的两个活塞,若_________ ,则整套装置不漏气。
(2)装置A中盛放的试剂是______,其作用是________。
(3)仪器C中选择Ba(OH)2而不选择Ca(OH)2溶液原因:__________、_________。
(4)下列各项措施中,能提高测定准确精度的是______________。(填标号)
a.在加入盐酸之前,应排净装置内的CO2气体
b.在A~B之间增添盛有浓硫酸的洗气装置
c.在B~C之间增添盛有饱和碳酸氢钠溶液的洗气装置
d.缓慢滴加稀盐酸
(5)如果没有装置D,则所测CaCO3的质量分数将_______。(选填“偏高”、“不变”或“偏低”)
(6)反应中盐酸必须过量,称量结束后,判断稀盐酸已过量的实验操作是___________ 。(写出实验步骤和现象)
(7)实验中准确称取16.00 g样品三份,进行三次测定,测得BaCO3平均质量为7.88 g,样品中碳酸钙的质量分数为 。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】CH4和CO2可以制造价值更高的化学产品。
已知:
CH4(g)+2O2(g)=CO2(g)+2H2O(g) ΔH1=-802.0 kJ·mol-1
CO(g)+H2O(g)![]() CO2(g)+H2(g) ΔH2=-41.2 kJ·mol-1
CO2(g)+H2(g) ΔH2=-41.2 kJ·mol-1
2CO(g)+O2(g)=2CO2(g) ΔH3=-566.0 kJ·mol-1
(1)求反应CH4(g)+CO2(g)![]() 2CO(g)+2H2(g) ΔH=________ kJ·mol-1(用含a、b、c的代数式表示)。
2CO(g)+2H2(g) ΔH=________ kJ·mol-1(用含a、b、c的代数式表示)。
(2)一定条件下,等物质的量的(1)中反应生成的气体可合成二甲醚(CH3OCH3),同时还产生了一种可参与大气循环的无机化合物,该反应的化学方程式为_____________________。
(3)用Cu2Al2O4作催化剂,一定条件下发生反应:CO2(g)+CH4(g)![]() CH3COOH(g),温度与催化剂的催化效率和乙酸的生成速率的关系如图,回答下列问题:
CH3COOH(g),温度与催化剂的催化效率和乙酸的生成速率的关系如图,回答下列问题:
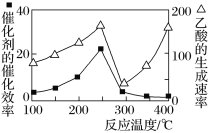
①250~300 ℃时,乙酸的生成速率降低的原因是________________________________。
②300~400 ℃时,乙酸的生成速率升高的原因是________________________________。
(4)已知:CO(g)+H2O(g)![]() CO2(g)+H2(g)。在850℃时,K=1。此温度下,若向一容积可变的密闭容器中同时充入1.0mol CO,3.0mol H2O,1.0mol CO2和xmol H2,则:
CO2(g)+H2(g)。在850℃时,K=1。此温度下,若向一容积可变的密闭容器中同时充入1.0mol CO,3.0mol H2O,1.0mol CO2和xmol H2,则:
①当x=5.0时,上述反应向______方向进行。
②若要使上述反应开始时向正反应方向进行,则x应满足的条件是______。
③在850℃时,若设x=5.0和x=6.0,其他物质的投料不变,当上述反应达到平衡后,测得H2的体积分数分别为a%、b%,则a______b(填“大于”“小于”或“等于”)。
(5)新型高效的甲烷燃料电池采用铂为电极材料,两电极上分别通入CH4和O2,电解质为KOH溶液。某研究小组用甲烷燃料电池进行饱和氯化钠溶液电解实验,如图所示:
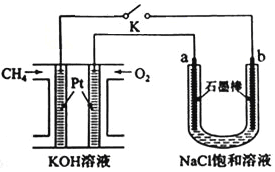
回答下列问题:
若电池甲烷通入量为1L(标准状况),且反应完全,则理论上通过电解池的电量为_______ (已知NA=6.02×1023mol-1,电子电荷量为1.60×10-19C,列式表示即可),最多能产生的氯气体积 为_______L(标准状况)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】达比加群酯,是由德国公司开发的新型口服抗凝血药物,针对急性和慢性血栓栓塞性疾病的预防及治疗。F是其合成过程中的重要中间体,以下是F的合成路线图:(-Me表示甲基)

(1)写出A中含氧官能团的名称:_________和__________。
(2)B→C的反应类型是______________________。
(3)写出C→D转化的化学方程式__________________________。
(4)写出符合条件的B的同分异构体的结构简式_________________。
①属于芳香族化合物 ②能发生银镜反应 ③分子中只有两种化学环境不同的氢原子
(5)已知:![]()
肉桂酰氯![]() 是一种重要的合成中间体,试写出以苯甲醇和乙醛为原料合成该化合物的合成路线流程图(无机原料任用)。
是一种重要的合成中间体,试写出以苯甲醇和乙醛为原料合成该化合物的合成路线流程图(无机原料任用)。
合成路线流程图示例如下:
![]()
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】氢氧燃料电池是符合绿色化学理念的新型电池。电池装置如图所示,该电池电极表面镀一层细小的铂粉,铂吸附气体的能力强,性质稳定。

请回答下列问题:
(1)氢氧燃料电池的能量转化主要形式是________,在导线中电子流动方向为________(用a、b表示)。
(2)负极反应式为__________________________________________________________。
(3)电极表面镀铂粉的原因是_____________________________________________。
(4)该电池工作时,H2和O2连续由外部供给,电池可连续不断地提供电能。因此大量安全储氢是关键技术之一。金属锂是一种重要的储氢材料,吸氢和放氢原理如下:
Ⅰ.2Li+H2![]() 2LiH
2LiH
Ⅱ.LiH+H2O===LiOH+H2↑
①反应Ⅰ中的还原剂是____________,反应Ⅱ中的氧化剂是____________。
②已知LiH固体密度为0.82 g/cm3。用锂吸收224 L(标准状况)H2,生成的LiH体积与被吸收的H2体积之比为________。
③由②生成的LiH与H2O作用,放出的H2用作电池燃料,若能量转化率为80%,则导线中通过电子的物质的量为________ mol。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com