
����Ŀ������������;������ȡ������������ͭ��
��ͭ��ϡ���ᷴӦ��
��ͭ��Ũ���ᷴӦ��
��ͭ����������Ӧ��������ͭ������ͭ�ٸ����ᷴӦ��������������ȷ����
A������;��������ͭ���������
B������;����������������ʵ����Ǣ�>��>��
C��;���۵��Ʊ���������ϡ���ɫ��ѧ������
D��;�����б�������ͭ�뱻��ԭ����������ʵ���֮����3��2
���𰸡�B
��������
�����������ȡ����ͭ���йط�Ӧ��ͭ��ϡ���ᷴӦ��![]() ����ͭ��Ũ���ᷴӦ��Cu+4HNO3(Ũ)=Cu��NO3��2+2NO2��+2H2O����ͭ����������Ӧ��������ͭ������ͭ�ٸ����ᷴӦ��2Cu+O2
����ͭ��Ũ���ᷴӦ��Cu+4HNO3(Ũ)=Cu��NO3��2+2NO2��+2H2O����ͭ����������Ӧ��������ͭ������ͭ�ٸ����ᷴӦ��2Cu+O2![]() 2CuO��CuO+2HNO3= Cu��NO3��2+H2O��A��ͭԪ�ض�����������ͭ��������ȡ����������ͭ����ͭ�����������A��ȷ��B�����������ķ�Ӧ;����Ϸ�Ӧʽ��֪����;����������������ʵ����Ǣ�>��>����B������C��;���۵��Ʊ�������ԭ����������ߣ���û����Ⱦ�����������������������ϡ���ɫ��ѧ��������C��ȷ��D��;�����б�������ͭ�뱻��ԭ����������ʵ���֮����3��2��D��ȷ����ѡB��
2CuO��CuO+2HNO3= Cu��NO3��2+H2O��A��ͭԪ�ض�����������ͭ��������ȡ����������ͭ����ͭ�����������A��ȷ��B�����������ķ�Ӧ;����Ϸ�Ӧʽ��֪����;����������������ʵ����Ǣ�>��>����B������C��;���۵��Ʊ�������ԭ����������ߣ���û����Ⱦ�����������������������ϡ���ɫ��ѧ��������C��ȷ��D��;�����б�������ͭ�뱻��ԭ����������ʵ���֮����3��2��D��ȷ����ѡB��



| �꼶 | ���пγ� | �꼶 | ���пγ� |
| ��һ | ��һ��ѿγ��Ƽ��� | ��һ | ��һ��ѿγ��Ƽ��� |
| �߶� | �߶���ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
| ���� | ������ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ������ȼ�ϵ���Ƿ�����ɫ��ѧ��������͵�ء����װ����ͼ��ʾ���õ�ص缫�����һ��ϸС�IJ��ۣ����������������ǿ�������ȶ���

��ش��������⣺
��1������ȼ�ϵ�ص�����ת����Ҫ��ʽ��________���ڵ����е�����������Ϊ________(��a��b��ʾ)��
��2��������ӦʽΪ__________________________________________________________��
��3���缫����Ʋ��۵�ԭ����_____________________________________________��
��4���õ�ع���ʱ��H2��O2�������ⲿ��������ؿ��������ϵ��ṩ���ܡ���˴�����ȫ�����ǹؼ�����֮һ���������һ����Ҫ�Ĵ�����ϣ�����ͷ���ԭ�����£�
����2Li��H2![]() 2LiH
2LiH
����LiH��H2O===LiOH��H2��
�ٷ�Ӧ���еĻ�ԭ����____________����Ӧ���е���������____________��
����֪LiH�����ܶ�Ϊ0.82 g/cm3���������224 L(��״��)H2�����ɵ�LiH����뱻���յ�H2���֮��Ϊ________��
���ɢ����ɵ�LiH��H2O���ã��ų���H2�������ȼ�ϣ�������ת����Ϊ80%��������ͨ�����ӵ����ʵ���Ϊ________ mol��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ����п (ZnS)��һ����Ҫ�Ļ���ԭ�ϣ�������ˮ��������п�ķ���п����ȡ���乤����������ͼ��ʾ��

��1��Ϊ���п�ҵĽ�ȡ�ʣ��ɲ��õķ����� ������ţ���
����ĥ �ڶ�ν�ȡ �������¶� �ܼ�ѹ �ݽ���
��2����������������е������� ��д��ѧʽ����
��3��������пɵ�Cd���ʣ�Ϊ���������µ����ʣ��Լ�bӦΪ____________��
��4������������Ի���Na2SO4����ȡNa2S��
�ټ���ZnS�����Ƿ�ϴ�Ӹɾ��ķ����� ��
��Na2S���ɵ����ʵ�����Na2SO4��CH4�ڸ��¡�������������ȡ����ѧ��Ӧ����ʽΪ________��
����֪Na2SO4��10H2O��Na2SO4���ܽ�����¶ȱ仯������ͼ������Һ�еõ�Na2SO4��10H2O�IJ��������� ��
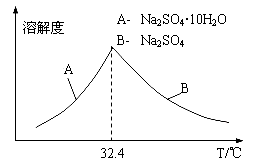
��5�������������ZnCO3Ϊb mol�����������CdΪd mol�����õ�VL�����ʵ���Ũ��Ϊc mol/L��Na2SO4��Һ��������������п���к���пԪ�ص�����Ϊ____________��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ������ѧ��-ѡ��2����ѧ�뼼����
�ʰ������������[��ѧʽΪ(NH2CH2COO)2Fe]�dz��õIJ���������ϳɷ������£�
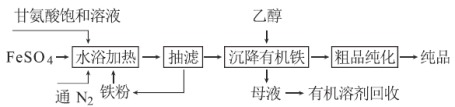
��1��ͨ��N2�������� ��
��2����֪�ʰ����������ԣ���ṹ��ʽΪNH2CH2COOH���ʰ������������������ˮ����ˮ���ѵ��룬д����ˮԡ���ȡ������������ʰ����������������Ӧ�����ӷ���ʽ ��
��3�����˵ĺô��� ���ӡ�ĸҺ���л����л��ܼ��ķ����� ��
��4������Ʒ�������IJ���Ϊ����ˮϴ�ӡ� ϴ�ӡ�������и�������ʹ�����豸���ѡ�� �����ѹ�����������ո����������
��5��������ָ�������ڡ�ˮԡ���ȡ�������Ͷ��������ʯ��ʯ������ͬʱ��߲�Ʒ�IJ��ʺʹ��ȣ������ԭ�� ��
��6�����ʰ����Ͷ����Ϊ300 kg��������Ʒ346.8 kg�������Ϊ �����ʰ������Է�������Ϊ75��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ����1����CaSO4����O2��ȼ��CO��Ӧ���ȿ����ȼ��Ч�ʣ����ܵõ��ߴ�CO2����һ�ָ�Ч����ࡢ���õ�����ȼ�ռ�������Ӧ��Ϊ����Ӧ����Ӧ�ں͢�Ϊ����Ӧ��
��1/4CaSO4(s)+CO(g) ![]() 1/4CaS(s)+CO2(g) H1
1/4CaS(s)+CO2(g) H1
��CaSO4(s)+CO(g) ![]() CaO(s)+CO2(g) +SO2(g) H2
CaO(s)+CO2(g) +SO2(g) H2
��CO(g) ![]() 1/2C(s)+1/2CO2(g) H3
1/2C(s)+1/2CO2(g) H3
��Ӧ2CaSO4(s)+7CO(g) ![]() CaS(s)+CaO(s)+6CO2(g)+C(s) +SO2(g)��H��
CaS(s)+CaO(s)+6CO2(g)+C(s) +SO2(g)��H��
����H1��H2��H3��ʾ��
��2����ȼú�����е�CO2ת��Ϊ�����ѵķ�Ӧԭ��Ϊ��
2CO2(g)��6H2(g) ![]() CH3OCH3(g)��3H2O(g)����H
CH3OCH3(g)��3H2O(g)����H
�ٸ÷�Ӧƽ�ⳣ������ʽΪK�� ��
����֪��ijѹǿ�£��÷�Ӧ�ڲ�ͬ�¶ȡ���ͬͶ�ϱ�ʱ��CO2��ת������ͼ��ʾ���÷�Ӧ�Ħ�H____(�������������=��)0�����¶Ȳ��䣬��С��ӦͶ�ϱ�[n(H2) /n(CO2)]����K�� (�������С�����䡱)��
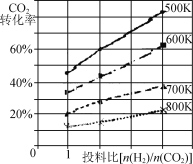
�۶�����ȼ�ϵ�ؾ��������죬Ч�ʸߵ��ŵ㣬�������Ϊ���ԣ�������ȼ�ϵ�صĸ�����ӦΪ ��
��3��һ����ͭ�����������������������̣�
����ͭ����������ɹ�ҵβ����SO2�IJ��ִ���������������ӦΪ��
2SO2��2nCu��(n��1)O2��(2��2n) H2O��2nCuSO4��(2��2n) H2SO4
�ӻ��������ĽǶȿ��������������Ϊ ��
��������ͼ��ʾ�绯ѧװ��������һ����SO2�������Cu��������д��װ������������Ӧ���ܵ����ӷ���ʽ�� ��
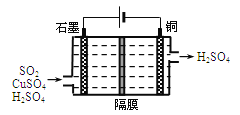
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��[��ѧ����ѡ��5���л���ѧ����]������A�ǻ����л�����ԭ�ϣ���A�Ʊ��߷���E��ҽҩ�м���K�ĺϳ�·��(���ַ�Ӧ������ȥ)��ͼ��ʾ��

�ش��������⣺
��1��A��������_____________��I���й����ŵ�������__________________��
��2�����ķ�Ӧ������________________�����ķ�Ӧ������________________��
��3��д����Ӧ���Ļ�ѧ����ʽ��______________________________________��
��4��D�����������_____________��ԭ�ӹ�ƽ�档E�Ľṹ��ʽΪ__________________��
��5��д��һ��ͬʱ��������������F��ͬ���칹��Ľṹ��ʽ��__________________��
��������ֻ�����ֲ�ͬ��ѧ��������ԭ�ӣ�
��������������Һ��Ӧ������NaOH��Һ��Ӧ��
��6������DΪ��ʼԭ���Ʊ�![]() �ĺϳ�·�߲���������
�ĺϳ�·�߲���������
 ________________________(���Լ����ܼ���ѡ)��
________________________(���Լ����ܼ���ѡ)��
�ϳ�·������ͼʾ�����£�![]()
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��ԭ��������С�������е����ֶ�����Ԫ��X��Y��Z��W������X��Z��W����Ԫ�ؿ����XH3��H2Z��HW���ۻ����Y����Ԫ�ؿ����Y2O��Y2O2�����ӻ����
��1��д��Y2O2�ĵ���ʽ��____ _�����к��еĻ�ѧ����___ _��
��2���õ���ʽ��ʾY2O���γɹ���________ _______��
��3��X��Z��W����Ԫ�ص�����������Ӧ��ˮ�����У�ϡ��Ũ��������ǿ����_____(�ѧʽ)��
��4��XH3��H2Z��HW���ֻ��������һ�����������ֶ��ܷ�Ӧ����__________(�ѧʽ)��
��5����X��Y��ɵĻ���������У�X��Wԭ�ӵ��������ﵽ8�����ȶ��ṹ���û�������ˮ������һ�־���Ư���ԵĻ������д����Ӧ�Ļ�ѧ����ʽ_______________ ____��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ������ѧ����ѡ��5���л���ѧ��������ɳ�������ֿ���ҩ����ϳ�·�����£�

��֪����NaNO2����ǿ������
 ��
��
��1��ˮ���������������ŵ�������___________��
��2��A�ķ���ʽ��___________��
��3��B��C�Ļ�ѧ����ʽ___________��
��4�������ϳ�·�߿������B��C�����������___________��
��5��D�Ľṹ��ʽ��___________��D��E�ķ�Ӧ������___________��
��6���л���G���ṹ��ʽ������ͼ��Ҳ�����ںϳɰ�ɳ���ء�����һ��ͬ���칹��X�Ǧ�-�����ᣬ����FeCl3��Һ������ɫ��Ӧ�������Ľṹ��_____�֣�д��һ��X���ܵĽṹ��ʽ________��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ����.��ʯȼ�ϵ�ȼ�ջ����������Ⱦ�����Ķ���������������������̼�� ����������Ϊ����̼����Ⱦ�������Դ��
��1��ijЩ�Ͻ�����ڴ����⣬���������ԭ���ɱ�ʾΪ��M+xH2![]() MH2x ��H<0 (M��ʾij�ֺϽ�)��ͼ��ʾ�¶ȷֱ�ΪT1�� T2ʱ�����������������ѹǿ�Ĺ�ϵ��������˵���У���ȷ���� ��
MH2x ��H<0 (M��ʾij�ֺϽ�)��ͼ��ʾ�¶ȷֱ�ΪT1�� T2ʱ�����������������ѹǿ�Ĺ�ϵ��������˵���У���ȷ���� ��

a��T1��T2
b����������ѹǿ���ӿ���������������
c������M����������ƽ�������ƶ�
d��������Ӧ��ʵ�ֶ�δ�����ͷ�����
��2����25����101KPa�����£�ag������ȫȼ������Һ̬ˮʱ�ų�142.9kJ���������ʾ����ȼ���ȵ��Ȼ�ѧ����ʽΪ ��
��3����ҵ��ͨ��������ˮú���ķ����Ƶ�����������C(s) +H2O(g) ![]() CO(g) + H2(g) ����850��ʱƽ�ⳣ��K= 1������1���ĺ����ܱ����������ͬʱ����x mol C��6.0mol H2O��
CO(g) + H2(g) ����850��ʱƽ�ⳣ��K= 1������1���ĺ����ܱ����������ͬʱ����x mol C��6.0mol H2O��
�ٵ����ȵ�850�棬��Ӧ�ﵽƽ��ı�־�� ��
A������ˮ���������ʵ���������CO�����ʵ������ B�������ڵ�ѹǿ����
C����������ܶȲ��� D����λʱ����n��H��O�����ѵ�ͬʱ��n��H��H������
��850��ʱ��Ӧ�ﵽƽ�⣬xӦ����������� ��
��������ͼ״�������ȼ�ϵ�أ����й����Ŀ�����Ӧ��ǰ�����ش���������

��4���״�ȼ�ϵ��(���DMFC)���ڽṹ������ת���ʸߡ��Ի�������Ⱦ������Ϊ������Դ�����Ʒ��Խ��Խ�ܵ���ע��DMFC����ԭ������ͼ��ʾ��ͨ��b����ĵ缫��ԭ��ص� ��(�� ����������)��ͨ��a����ĵ缫��ӦʽΪ ��
��5��ij�о�С�齫��������ȼ�ϵ�ش�������Ϊ��Դ�����б����Ȼ�����Һ���ʵ�飬��ͼ��ʾU�ι����Ȼ�����Һ�����Ϊ80ml���պ�K����ÿ����ؼ���������Ϊ0.224L(���)���ҷ�Ӧ��ȫ����������ͨ�����صĵ���Ϊ (������λС������֪�����ڳ���F=9.65��104C/mol)��������������ȫ���ݳ���������Һ��Ͼ��ȣ�����U�ι�����Һ��pHΪ ��

�鿴�𰸺ͽ���>>
����ѧУ��ѡ - ��ϰ���б� - �����б�
����ʡ������Υ���Ͳ�����Ϣ�ٱ�ƽ̨ | �����к���Ϣ�ٱ�ר�� | ����թƭ�ٱ�ר�� | ����ʷ���������к���Ϣ�ٱ�ר�� | ������Ȩ�ٱ�ר��
Υ���Ͳ�����Ϣ�ٱ��绰��027-86699610 �ٱ����䣺58377363@163.com