
【题目】如图两圆相交部分A、B、C、D分别表示两物质间的反应。下列各对应反应的离子方程式书写不正确的是( )
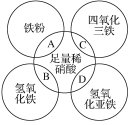
A.Fe+4H++NO3-=Fe3++NO↑+2H2O
B.Fe(OH)3+3H+=Fe3++3H2O
C.Fe3O4+8H+=Fe2++2Fe3++4H2O
D.3Fe(OH)2+10H++NO3-=3Fe3++NO↑+8H2O
【答案】C
【解析】
A.稀硝酸是强氧化性酸,能将铁单质直接氧化为Fe3+,故铁和足量稀硝酸的离子方程式为:Fe+4H++NO3-═Fe3++NO↑+2H2O,故A正确;
B.Fe(OH)3中铁元素为+3价,为铁元素的最高价态,只有氧化性无还原性,故和硝酸反应时,硝酸只能体现酸性,不能体现氧化性,故离子方程式为:Fe(OH)3+3H+═Fe3++3H2O,故B正确;
C.Fe3O4中铁元素有+2价和+3价,而稀硝酸是强氧化性酸,能将Fe2+氧化为Fe3+,故正确的离子方程式为:3Fe3O4+NO3-+28H+═9Fe3++NO+14H2O,故C错误;
D.Fe(OH)2中铁元素为+2价,有较强还原性,故Fe(OH)2既有碱性又有强还原性,故和硝酸反应时,会被硝酸氧化为Fe3+,故离子方程式为:3Fe(OH)2+10H++NO3-═3Fe3++NO↑+8H2O,故D正确;
故答案为C。


科目:高中化学 来源: 题型:
【题目】下图是部分短周期元素原子(用字母表示)最外层电子数与原子序数的关系图。说法正确的是( )
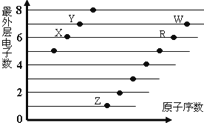
A. X与W形成的化合物中只有共价键
B. X与Z形成的化合物中只有离子键
C. 元素的非金属性:X>R>W
D. 简单离子的半径:W>R>X
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某固体混合物可能由Fe2O3、Fe、Na2SO3、NaBr、AgNO3、BaCl2中的两种或两种以上的物质组成。某兴趣小组为探究该固体混合物的组成,设计的部分实验方案如图所示:
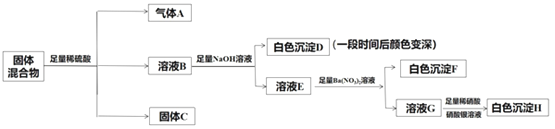
下列说法正确的是
A.气体A至少含有SO2、H2中的一种
B.固体C可能含有BaSO4或者Ag2SO4
C.该固体混合物中Fe2O3和Fe至少有其中一种
D.该固体混合物一定含有BaCl2,其余物质都不确定
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】X、Y、Z、W是四种原子序数依次增大的短周期元素,W的最外层电子数为X最外层电子数的一半,X、Y、Z的原子半径依次减小,X、Y、Z组成的一种化合物(ZXY)2的结构式为Y≡X—Z—Z—X≡Y。下列说法正确的是
A.(XY)2中X元素的化合价为+3
B.Y的氧化物对应的水化物是强酸
C.化合物W(Y3)2中只含有离子键
D.X和Z组成的化合物中不可能所有原子都达到8电子稳定结构
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列物质有如下转化关系![]() 有的生成物未列出
有的生成物未列出![]() ,其中:D为碱,G为酸,金属甲在G 的浓溶液中会钝化;F的溶液中只含一种溶质.
,其中:D为碱,G为酸,金属甲在G 的浓溶液中会钝化;F的溶液中只含一种溶质.
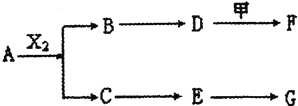
A、B、C、D、E均由Q、R、X、T四种短周期元素中的两种或三种组成,且Q、R、X、T原子序数依次增大;X的最外层电子数是电子层数的3倍;R和X相邻;Q和T同主族,Q为非金属元素,T为金属元素.则:
(1)X在周期表中的位置是 ______ ,R、X、T的原子半径从小到大的顺序为 ______ ![]() 用元素符号表示
用元素符号表示![]() ;
;
(2)A和G等物质的量反应产物的水溶液显 ______ 性,其原因用离子方程式表示为 ______ ;
(3)A和X2反应的化学方程式为 ______ ;
(4)pH均为12的D溶液和F溶液中,水电离出的c(OH-)之比为 ______ ;
(5)为保护环境,通过安装汽车尾气处理装置,使尾气中的E和CO反应转化为两种空气的成分,当反应转移1 mol电子时,生成的气体在标准状况下的总体积为 ______ L。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某课外学习小组对日常生活中不可缺少的调味品M进行探究。已知C可在D中燃烧发出苍白色火焰。M与其他物质的转化关系如图1所示(部分产物已略去):
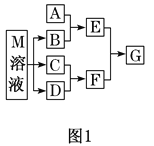
(1)写出B的电子式________。
(2)若A是一种非金属单质,且可用于制造半导体材料,写出A和B水溶液反应的离子方程式__________________________。
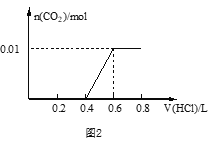
(3)若A是CO2气体,A与B溶液能够反应,反应后所得的溶液再与盐酸反应,生成的CO2物质的量与所用盐酸体积如图2所示,则A与B溶液反应后溶液中所有溶质的化学式为_____________;c(HCl)=________mol/L。
(4)若A是一种常见金属单质,且A与B溶液能够反应,则将过量的F溶液逐滴加入E溶液,边加边振荡,所看到的实验现象是______________________________________。
(5)若A是一种可用于做氮肥的化合物, A和B反应可生成气体E,E与F、E与D相遇均冒白烟,且利用E与D的反应检验输送D的管道是否泄露,写出E与D反应的化学方程式为___________________。
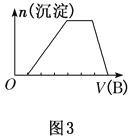
(6)若A是一种溶液,可能含有H+、NH![]() 、Mg2+、Fe3+、Al3+、CO32-、SO42-中的某些离子,当向该溶液中加入B溶液时发现生成沉淀的物质的量随B溶液的体积发生变化如图3所示,由此可知,该溶液中肯定含有的离子是_____________________,它们的物质的量浓度之比为______________。
、Mg2+、Fe3+、Al3+、CO32-、SO42-中的某些离子,当向该溶液中加入B溶液时发现生成沉淀的物质的量随B溶液的体积发生变化如图3所示,由此可知,该溶液中肯定含有的离子是_____________________,它们的物质的量浓度之比为______________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】GaN是制造5G芯片的材料,氮化镓铝和氮化铝LED可发出紫外光。回答下列问题:
(1)基态As原子核外电子排布式为[Ar]____________;下列状态的铝元素中,电离最外层的一个电子所需能量最小的是______________(填标号)。
A.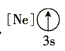 B.
B.![]() C.
C.![]() D.
D.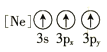
(2)8—羟基喹啉合铝(分子式C27H18AlN3O3)用于发光材料及电子传输材料,可由LiAlH4与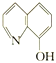 8—羟基喹啉)合成。LiAlH4中阴离子的空间构型为______________; 8—羟基喹啉合铝中所含元素电负性最大的是______________(填元素符号,下同),第一电离能最大的是__________(填元素符号),N原子的杂化方式为_____________。
8—羟基喹啉)合成。LiAlH4中阴离子的空间构型为______________; 8—羟基喹啉合铝中所含元素电负性最大的是______________(填元素符号,下同),第一电离能最大的是__________(填元素符号),N原子的杂化方式为_____________。
(3)已知下列化合物的熔点:
化合物 | AlF3 | GaF3 | AlCl3 |
熔点/℃ | 1040 | 1000 | 194 |
①表格中卤化物的熔点产生差异的原因是_______________________________________________。
②熔融AlCl3时可生成具有挥发性的二聚体Al2Cl6分子,分子中每个原子最外层均达到8电子,二聚体Al2Cl6的结构式为______________________________;其中Al的配位数为_________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】Q、W、X、Y、Z五种短周期元素在周期表中的相对位置如下图所示,其中W的单质是一种重要半导体材料。
|
|
| Y |
|
Q | W | X |
| Z |
请按要求回答下列问题:
(1)Y的原子结构示意图为________;举一例说明Z的非金属性比X的非金属性强的事实:________。
(2)W、X、Y的原子半径由大到小依次![]() 填元素符号
填元素符号![]() ________:W与Z形成的化合物电子式为________。
________:W与Z形成的化合物电子式为________。
(3)将Z的单质通入到含等物质的量FeBr2溶液中充分反应的离子方程式为________。
(4)已知: 2Na(s)+![]() Y2(g)=Na2Y(s)H=-414kJ/mol;2Na(s)+Y2(g)=Na2Y2(s)H=-511kJ/mol;则Na2Y(s)转变为Na2Y2(s)的反应一定条件下能自发进行的理由是________。将0.2mol Na2Y2加入到100mL1mol/L的QZ3中,充分反应的化学方程式为________。
Y2(g)=Na2Y(s)H=-414kJ/mol;2Na(s)+Y2(g)=Na2Y2(s)H=-511kJ/mol;则Na2Y(s)转变为Na2Y2(s)的反应一定条件下能自发进行的理由是________。将0.2mol Na2Y2加入到100mL1mol/L的QZ3中,充分反应的化学方程式为________。
(5)R与W同周期,已知:在T℃时Ksp[R(OH)2]的值为4.0×10-12,则R(OH)2饱和溶液中c(OH-)=________mol/L。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com