
【题目】四种短周期主族元素W、X、Y、Z的原子序数依次增大,W、X的简单离子具有相同电子层结构,X的原子半径是短周期主族元素原子中最大的,W与Y同族,W、X、Y形成的化合物为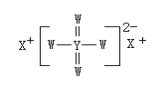 ,下列说法正确的是( )
,下列说法正确的是( )
A.简单离子半径:W<X<Z
B.X与Z形成的化合物溶于水后溶液呈中性
C.气态氢化物的热稳定性:W<Y
D.最高价氧化物的水化物的酸性:Y>Z
【答案】B
【解析】
四种短周周期主族元素W、X、Y、Z的原子序数依次增大,X的原子半径是短周期主族元素原子中最大的,则X为Na元素, W、X的简单离子具有相同电子层结构,W与Y同族,则Y为S,W为O,那么Z只能是Cl。根据W、X、Y形成的化合物的结构可知,该化合物为Na2SO4。
A.电子层越多,离子半径越大,具有相同电子排布的离子中原子序数大的离子半径小,则简单离子半径: X< W< Z,A错误;
B.X与Z形成的化合物为NaCl,NaCl水溶液是中性,B正确;
C.非金属性O> S,则气态氢化物的热稳定性:W>Y,C错误;
D.非金属性Z> Y,最高价氧化物的水化物的酸性:Y<Z,D错误;
故选B。


科目:高中化学 来源: 题型:
【题目】25℃时,体积均为25. 00 mL,浓度均为0.0100 mol/L的HA、H3B溶液分别用0.0100mol/L NaOH溶液滴定,溶液的pH随V(NaOH)变化曲线如图所示,下列说法中正确的是

A.NaOH溶液滴定HA溶液可选甲基橙作指示剂
B.均为0. 0100 mol/L HA、H3B溶液中,酸性较强的是HA
C.25℃时,0. 0100 mol/L Na2HB溶液的pH >7
D.25℃时,向Na2HB溶液中滴加HA溶液反应的离子方程式为:HB2- + HA == H2B- + A-
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某化学兴趣小组进行有关Cu、硝酸、硫酸化学性质的实验,实验过程如图所示。下列有关说法正确的是
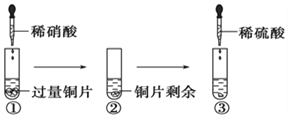
A.①中溶液呈蓝色,试管口有红棕色气体产生,稀硝酸被还原为NO2
B.③中反应的化学方程式:3Cu+Cu(NO3)2+4H2SO4=4CuSO4+2NO↑+4H2O
C.③中滴加稀硫酸,铜片继续溶解,说明稀硫酸的氧化性比稀硝酸强
D.由上述实验可知:Cu在常温下既可与稀硝酸反应,也可与稀硫酸反应
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】金属铝在生产生活中有着广泛的用途。回答下列问题:
(1)铝元素在周期表中的位置是_______________。
(2)比较原子结构示意图:它们的共同之处是___________![]() 选填编号,下同
选填编号,下同![]() ;不同之处是___________。
;不同之处是___________。
a.电子层数b.次外层电子数c.最外层电子数d.质子数
(3)常温下铝制容器可以用来盛放浓硫酸而不被溶解,这种现象称为___________。
氢氧化铝和盐酸反应的化学方程式为_________________________________。
能把溶液中的铁离子和铝离子分离开的试剂是___________。![]() 选填编号
选填编号![]()
a.盐酸b.硫酸铜溶液 c.氨水 d.氢氧化钠溶液
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】非金属单质A经如图所示的过程转化为含氧酸D,已知D为强酸,请回答下列问题:
![]()
(1)若A在常温下为固体单质,B是能使品红溶液褪色的有刺激性气味的无色气体。
①写出B→C的化学方程式________________________________________。
②写出D+铜→B的化学方程式____________________________________。
(2)若A在常温下为气体单质,将装满气体C的试管倒扣在水槽中,溶液最终充满试管容积的![]() ,另外
,另外![]() 容积为无色气体。
容积为无色气体。
①A、C的化学式分别是:A____________;C___________。
②D的浓溶液在常温下可与铜反应并生成C气体,请写出该反应的离子方程式____。
(3)若A在常温下为非金属气态氢化物,B遇到空气变成红棕色。写出实验室制取A气体的化学方程式______。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列说法正确的是
A.0.1mol/L NaHSO3溶液pH=5.6,溶液中粒子浓度 c (HSO3-)> c (H2SO3)>c (SO32-)
B.将Na2CO3固体溶于水配成溶液,再向溶液中加水,由水电离出的c(H+)·c(OH-)增大
C.碳酸氢钠溶液中:c(OH-)+c(CO32-)=c(H+)+c(H2CO3)
D.等体积、等物质的量浓度的Na2CO3和NaHCO3溶液混合: <
<
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某学习小组同学根据影响化学反应速率的因素进行实验验证,其设计的实验方案如下:请你帮他们把表填写完整,并做出评价。
(1)甲同学验证还原性:I->Br-
实验步骤 | 实验现象 | 实验结论及离子反应式 |
| 逐滴加入的同时振荡,观察CCl4层的颜色: 甲___ 乙___; 乙中CCl4层颜色明显变化的快。 | 离子方程式: 甲__ 乙__ 结论:验证成立,还原性,I->Br- |
(评价)甲同学设计的实验方案是__(填“合理”或“不合理”),理由是__。
(3)乙同学验证固体反应物的颗粒大小的对反应速率影响
实验步骤:在试管①中加入1g粉末状大理石,加入4mol/L盐酸20mL(过量);在试管②中加入2g颗粒状大理石,加入4mol/L盐酸20mL(过量)。他根据实验过程,绘制出的生成CO2生成体积(折算成标准状况)V(CO2)同反应时间t的关系曲线图,你认为__是符合的。

查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】电化学在化学工业有着广泛的应用,
(1)工业冶炼铝的化学方程式是______;
(2)工业级氢氧化钾的溶液中含有某些含氧酸根杂质,可用离子交换法膜法电解提纯。电解槽内装有阳离子交换膜(只允许阳离子通过),其工作原理如图所示。
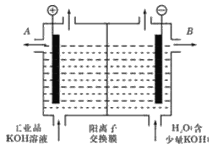
①该电解槽的阳极反应式是________;
②除去杂质后的氢氧化钾溶液从液体出口_______(填写“A”或“B”)导出。
(3)爱迪生蓄电池的反应式为:Fe+NiO2+2H2O![]() Fe(OH)2+Ni(OH)2;高铁酸酸钠(Na2FeO4)是一种新型净水剂.用下面装置可以制取少量高铁酸钠。
Fe(OH)2+Ni(OH)2;高铁酸酸钠(Na2FeO4)是一种新型净水剂.用下面装置可以制取少量高铁酸钠。
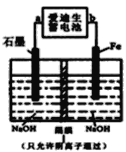
①此装置中爱迪生蓄电池的负极是________(填“a”或“b”),该电池工作一段时间后必须充电,充电时生成NiO2的反应类型是______。
②写出在用电解法制取高铁酸钠时,阳极的电极反应式_________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】普通锌锰电池筒内无机物主要成分为MnO2、NH4Cl、ZnCl2等。某研究小组探究废于电池内的黑色固体并回收利用时,进行如图所示实验。下列有关实验的叙述正确的是
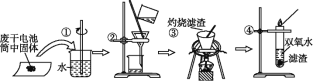
A. 操作①中玻璃棒的作用是转移固体 B. 操作②为过滤,得到的滤液显碱性
C. 操作③中盛放药品的仪器是坩埚 D. 操作④的目的是除去滤渣中的杂质
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com