
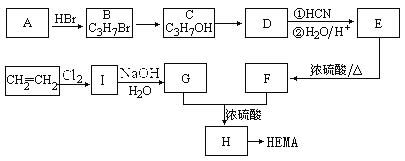
【题目】软性隐形眼镜可由聚甲基丙烯酸羟乙酯(HEMA)制成超薄镜片,其合成路线可以是:
已知:① 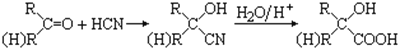
② CH3COOCH2CH2OH的名称为乙酸羟乙酯。
试写出:
(1)A、D、E的结构简式分别为:
A______________________、D_______________________、E______________________。
(2)写出下列反应的反应类型:C→D___________________,E→F__________________。
(3)写出下列转化的化学方程式:
I→G________________________________________________________________________;
H→HEMA___________________________________________________________________。
【答案】 CH2=CHCH3 CH3COCH3 (CH3)2C(OH)COOH 氧化反应 消去反应 CH2ClCH2Cl+2H2O![]() HOCH2CH2OH+2HCl或:CH2ClCH2Cl+2NaOH
HOCH2CH2OH+2HCl或:CH2ClCH2Cl+2NaOH ![]() HOCH2CH2OH+2NaCl
HOCH2CH2OH+2NaCl 
【解析】A为丙烯CH2=CHCH3 与HBr发生加成反应得到B:C3H7Br。C3H7Br与NaOH的水溶液发生取代反应得到C:C3H7OH。C催化氧化得到D:丙酮CH3COCH3 ;丙酮在HCN和H2O、H+ 作用下反应得到E:(CH3)2C(OH)COOH。E在浓硫酸作用下加热发生消去反应得到F:![]() ;CH2=CH2 与Cl2 发生加成反应得到I:1,2—二氯乙烷CH2Cl-CH2Cl; 1,2—二氯乙烷CH2Cl-CH2Cl在NaOH的水溶液中发生取代反应得到G:乙二醇HOCH2CH2OH。F:
;CH2=CH2 与Cl2 发生加成反应得到I:1,2—二氯乙烷CH2Cl-CH2Cl; 1,2—二氯乙烷CH2Cl-CH2Cl在NaOH的水溶液中发生取代反应得到G:乙二醇HOCH2CH2OH。F:![]() 与G 发生酯化反应得到H:
与G 发生酯化反应得到H:![]() 和水。H发生加聚反应得到HEMA。(1)A、D、E的结构简式分别为:CH2=CHCH3、CH3COCH3、(CH3)2C(OH)COOH;(2)C→D是CH3CH(OH) CH3催化氧化得到CH3COCH3,反应类型为加成反应;E→F是(CH3)2C(OH)COOH在浓硫酸作用下加热发生消去反应得到
和水。H发生加聚反应得到HEMA。(1)A、D、E的结构简式分别为:CH2=CHCH3、CH3COCH3、(CH3)2C(OH)COOH;(2)C→D是CH3CH(OH) CH3催化氧化得到CH3COCH3,反应类型为加成反应;E→F是(CH3)2C(OH)COOH在浓硫酸作用下加热发生消去反应得到![]() ,反应类型为消去反应;(3)I→G的反应方程式为:CH2ClCH2Cl+2H2O
,反应类型为消去反应;(3)I→G的反应方程式为:CH2ClCH2Cl+2H2O![]() HOCH2CH2OH+2HCl 或:CH2ClCH2Cl+2NaOH
HOCH2CH2OH+2HCl 或:CH2ClCH2Cl+2NaOH ![]() HOCH2CH2OH+2NaCl;H→HEMA的化学方程式为:
HOCH2CH2OH+2NaCl;H→HEMA的化学方程式为: 。
。


 智趣暑假温故知新系列答案
智趣暑假温故知新系列答案 英语小英雄天天默写系列答案
英语小英雄天天默写系列答案 暑假作业安徽少年儿童出版社系列答案
暑假作业安徽少年儿童出版社系列答案科目:高中化学 来源: 题型:
【题目】甲图中①、②、③、④表示不同化学元素所组成的化合物,乙图表示由四个单体构成的化合物,以下说法正确的是
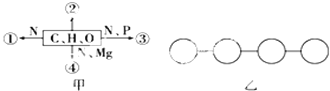
A. 甲图中的②大量存在于皮下和内脏器官周围等部位,则②只在动物细胞中能找到
B. 甲图中③是细胞中的遗传物质,则蓝藻细胞的③为DNA和RNA
C. 乙图中若单体是氨基酸,则该化合物彻底水解后的产物中氢原子数增加3个
D. 乙图中若单体是4种脱氧核苷酸,则该化合物彻底水解后的产物最多有6种
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】A、B、C、D为四种单质,常温时,A、B是气体,C、D是固体.E、F、G、H、I为五种化合物,F不溶水,E为气体且极易溶水成为无色溶液,G溶于水得黄棕色溶液.这九种物质间反应的转化关系如图所示 
(1)写出四种单质的化学式 ABCD
(2)写出H+B→G的离子方程式;
(3)写出G+I→H+D+E的化学方程式;
(4)某工厂用B制漂白粉. ①写出制漂白粉的化学方程式 .
②为测定该工厂制得的漂白粉中有效成分的含量,某该小组进行了如下实验:称取漂白粉3.0g,研磨后溶解,配置成250mL溶液,取出25.00mL加入到锥形瓶中,再加入过量的KI溶液和过量的硫酸(此时发生的离子方程式为:),静置.待完全反应后,用0.2molL﹣1的Na2S2O3溶液做标准溶液滴定反应生成的碘,已知反应式为:2Na2S2O3+I2=Na2S4O6+2NaI,共用去Na2S2O3溶液20.00mL.则该漂白粉中有效成分的质量分数为保留到小数点后两位).
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在一定温度下,容器内某一反应中M、N的物质的量随反应时间变化的曲线如图所示,下列表述正确的是 ( )
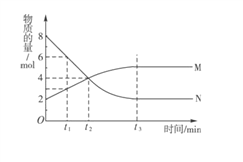
A. 化学方程式为2MN B. t2时,正逆反应速率相等,达到平衡
C. t2时,正反应速率大于逆反应速率 D. t1时,M的浓度是N浓度的2倍
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列说法中错误的是( )
A.原子的核外电子层数等于该元素所在的周期数
B.元素周期表中从IIIB族到IIB族10个纵行的元素都是金属元素
C.除氦外的稀有气体原子的最外层电子数都是8
D.同一元素的各种同位素的物理性质、化学性质均相同
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】(1)已知: 2SO2(g)+O2(g)![]() 2SO3(g) △H=-XkJ/mol;
2SO3(g) △H=-XkJ/mol;
2NO(g)+O2(g)![]() 2NO2(g) △H=-YkJ/mol。
2NO2(g) △H=-YkJ/mol。
则反应NO(g)+SO2(g)![]() SO3(g)+NO(g) 的△H=______ kJ/mol。
SO3(g)+NO(g) 的△H=______ kJ/mol。
(2)甲烷是一种高效清洁的新能源,0.25mol甲烷完全燃烧生成液态水时放出热量222.5kJ,则甲烷燃烧的热化学方程式为____________。
(3)以KOH溶液为电解质溶液,依据(2)中反应设计一个原电池,其负极反应式为_______;以H2SO4溶液为电解质溶液,将甲烷燃料电池中的甲烷改为C2H5OH,其负极反应式为_________。
(4)以上述甲烷燃料电池为电源,用铂电极电解1LCu(NO3)2和KNO3混合溶液,通电一段时间,两极均产生11.2L(标准状况)气体。则电解后溶液的pH为______(电解过程中溶液体积不变),原混合溶液中Cu2+的物质的量浓度为___________,假设电解过程中能量利用率为80%,在甲烷燃料电池中消耗的甲烷在标准状况下的体积为________L。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】将过氧化钠投入到氯化亚铁溶液中,可观察到的现象是( )
A. 最终生成白色沉淀 B. 最终生成红褐色沉淀
C. 最终出现灰绿色沉淀 D. 无变化
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】电解原理在化学工业中有广泛应用.如图表示一个电解池,装有电解液a;X、Y是两块电极板,通过导线与直流电源相连.请回答以下问题: 
(1)若X、Y都是惰性电极,a是饱和NaCl溶液,实验开始时,同时在两边各滴入几滴酚酞试液,则①电解池中X极上的电极反应式为 . 在X极附近观察到的实验现象是 . ②Y电极上的电极反应式为 .
③要使电解后溶液恢复到电解前的状态,则需加入(或通入) .
(2)如果要用电解方法精炼粗铜,电解液a选用CuSO4溶液,则: ①X电极的材料是 , 电极反应式为 .
②Y电极的材料是 , 电极反应式为 . (说明:杂质发生的电极反应不必写出)
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com