
【题目】下列有关实验的选项正确的是 ( )
A.  X若为苯,可用于吸收NH3或HCl,并防止倒吸
X若为苯,可用于吸收NH3或HCl,并防止倒吸
B. 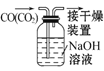 除去CO中的CO2
除去CO中的CO2
C.  可用于分离C2H5OH和H2O的混合物
可用于分离C2H5OH和H2O的混合物
D. 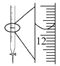 记录滴定终点读数为12.20 mL
记录滴定终点读数为12.20 mL
科目:高中化学 来源: 题型:
【题目】我国学者近期发表在 Green Chemistry 的研究成果是将电解食盐水的阳极反应与电催化还原 CO2 的阴极反应相耦合,反应原理的示意图如图所示。下列说法错误的是

A.阳极反应为2Cl--2e- = Cl2↑
B.装置中的离子交换膜是质子交换膜
C.整个反应过程中碳、氯、氧的原子利用率接近 100%
D.这种耦合为提高 CO2 电化学还原的实际应用提供了思路
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】金属钠是在1807年通过电解氢氧化钠制得的,这个原理应用于工业生产,约在1891年才获得成功。1921年实现了电解氯化钠制钠的工业方法,其反应原理是:2NaCl(熔融)![]() 2Na+Cl2↑。回答下列有关单质钠的问题:
2Na+Cl2↑。回答下列有关单质钠的问题:
(1)下列各项中属于保存金属钠的正确方法是___。
A.放在棕色瓶中 B.放在细沙中 C.放在水中 D.放在煤油中
(2)钠长时间放在空气中,最后的产物主要成分是___。
A.Na2O B.Na2O2 C.NaOH D.Na2CO3
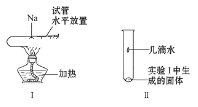
(3)将一小块钠放在水平放置的试管中部,用酒精灯加热充分反应(如图Ⅰ所示),请写出该反应的化学方程式___,生成物的颜色为___。将该试管冷却后直立,滴加几滴水(如图Ⅱ所示),发生反应的离子方程式为___,检验该反应产生的气体的方法是___。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】现有一份含有FeCl3和FeCl2的固体混合物,某化学兴趣小组为测定各成分的含量进行如下两个实验:
实验1 ①称取一定质量的样品,将样品溶解;
②向溶解后的溶液中加入足量的AgNO3溶液,产生沉淀;
③将沉淀过滤、洗涤、干燥得到白色固体28.7 g
实验2 ①称取与实验1中相同质量的样品,溶解;
②向溶解后的溶液中通入足量的Cl2;
③再向②所得溶液中加入足量的NaOH溶液,得到红褐色沉淀;
④将沉淀过滤、洗涤后,加热灼烧到质量不再减少,得到固体Fe2O36.40g
根据实验回答下列问题:
(1)溶解过程中所用到的玻璃仪器有________
(2)实验室保存FeCl2溶液时通常会向其中加入少量的铁粉,其作用是_________
(3)用化学方程式表示实验2的步骤②中通入足量Cl2的反应:___________
(4)用容量瓶配制实验所用的NaOH溶液,下列情况会使所配溶液浓度偏高的是(填序号)_______。
a.未冷却溶液直接转移
b.没用少量蒸馏水洗涤烧杯和玻璃棒2~3次并转入容量瓶
c.加蒸馏水时,不慎超过了刻度线
d.砝码上沾有杂质
e.容量瓶使用前内壁沾有水珠
(5)检验实验2的步骤④中沉淀洗涤干净的方法是___________
(6)该小组每次称取的样品中含有FeCl2的质量为_________g
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】(1)3.01×1023个NH4+含有质子的物质的量是______mol,含有电子的物质的量是______mol。
(2)200mL 2mol/L的Al2(SO4)3 溶液中SO42-的物质的量浓度为_________。
(3)标准状况下36g H2和O2组成的混合气体的体积是67.2L 。求这种混合气体中H2和O2的体积比为____________。
(4)同温同压下,质量比为17:48的NH3和CH4两种气体,密度之比为_________。
(5)已知1.505×1023个A气体分子质量为31g ,则A气体的摩尔质量是_________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】M、R、X、Y为原子序数依次增大的短周期主族元素,Z是一种过渡元素。M基态原子L层中p轨道电子数是s轨道电子数的2倍,R是同周期元素中最活泼的金属元素,X和M形成的一种化合物是引起酸雨的主要大气污染物,Z的基态原子4s和3d轨道半充满。请回答下列问题:
(1)R基态原子的电子排布式是_____,X和Y中电负性较大的是__(填元素符号)。
(2)X的氢化物的沸点低于与其组成相似的M的氢化物,其原因是___________。
(3)X与M形成的XM3分子的空间构型是__________。
(4)M和R所形成的一种离子化合物R2M晶体的晶胞如图所示,则图中黑球代表的离子是_________(填离子符号)。
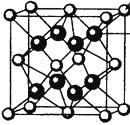
(5)在稀硫酸中,Z的最高价含氧酸的钾盐(橙色)氧化M的一种氢化物,Z被还原为+3价,该反应的化学方程式是____________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】C、H、O、N 是构成生命的基本元素,是中学化学研究的重要内容之一。
(1)对碳原子核外两个未成对电子的描述,正确的是_____
A. 电子云形状不同
B. 自旋方向相同
C. 能量不同
D. 在同一轨道
(2)C、O、N 三种元素第一电离能由大到小的顺序是_____
(3)HCHO 分子中碳原子轨道的杂化类型是_____,福尔马林(HCHO 的水溶液),HCHO 极易与水互溶的主要原因是_____
(4)在有机银镜反应实验中其中一种反应物是配合物,写出此配合物离子的结构简式_____,提供孤电子对的成键原子是_____。
(5)如图是金刚石晶胞,每个碳原子的配位数是_____;每个晶胞中含有的碳原子个数是_____;若晶胞的边长是anm,该晶胞中两个碳原子之间的最短距离为_____nm。

查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知还原性:Fe2+>Br-。向100mLFeBr2溶液中通入3.36L(标准状况)Cl2,反应后的溶液中Cl-和Br-的物质的量浓度相等,则原溶液中FeBr2的物质的量浓度为( )
A. 2 mol·L-1 B. 1.5 mol·L-1 C. 1 mol·L-1 D. 0.75 mol·L-1
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com