
【题目】现有一份含有FeCl3和FeCl2的固体混合物,某化学兴趣小组为测定各成分的含量进行如下两个实验:
实验1 ①称取一定质量的样品,将样品溶解;
②向溶解后的溶液中加入足量的AgNO3溶液,产生沉淀;
③将沉淀过滤、洗涤、干燥得到白色固体28.7 g
实验2 ①称取与实验1中相同质量的样品,溶解;
②向溶解后的溶液中通入足量的Cl2;
③再向②所得溶液中加入足量的NaOH溶液,得到红褐色沉淀;
④将沉淀过滤、洗涤后,加热灼烧到质量不再减少,得到固体Fe2O36.40g
根据实验回答下列问题:
(1)溶解过程中所用到的玻璃仪器有________
(2)实验室保存FeCl2溶液时通常会向其中加入少量的铁粉,其作用是_________
(3)用化学方程式表示实验2的步骤②中通入足量Cl2的反应:___________
(4)用容量瓶配制实验所用的NaOH溶液,下列情况会使所配溶液浓度偏高的是(填序号)_______。
a.未冷却溶液直接转移
b.没用少量蒸馏水洗涤烧杯和玻璃棒2~3次并转入容量瓶
c.加蒸馏水时,不慎超过了刻度线
d.砝码上沾有杂质
e.容量瓶使用前内壁沾有水珠
(5)检验实验2的步骤④中沉淀洗涤干净的方法是___________
(6)该小组每次称取的样品中含有FeCl2的质量为_________g
【答案】烧杯、玻璃棒 防止溶液里的Fe2+ 被氧化 Cl2 + 2FeCl2 = 2FeCl3 ad 取少量最后一次的洗涤液于试管中 ,向试管中溶液加适量AgNO3溶液 ,如未出现白色沉淀说明已洗净 5.08
【解析】
(1)溶解所用到的仪器为烧杯、玻璃棒;
(2)FeCl2易被空气中的氧气氧化成FeCl3;
(3)Cl2将FeCl2氧化生成FeCl3;
(4)分析操作对溶质的物质的量或对溶液的体积的影响,根据c=![]() 分析判断;
分析判断;
(5)氯化钠和硝酸银反应生成氯化银沉淀和硝酸钠;
(6)依据原子个数守恒建立方程组求解。
(1)溶解过程中所用到的玻璃仪器有烧杯、玻璃棒,故答案为:烧杯、玻璃棒;
(2)FeCl2易被空气中的氧气氧化成FeCl3,向溶液中加入少量铁粉,使被氧气氧化产生的FeCl3重新转化为FeCl2,故答案为:防止溶液里的Fe2+被氧化;
(3)实验2的反应为Cl2将FeCl2氧化生成FeCl3,反应的化学方程式为Cl2+2FeCl2=2FeCl3,故答案为:Cl2+2FeCl2=2FeCl3;
(4)a、NaOH溶解放热,未冷却溶液直接转移,会导致溶液体积偏小,溶液浓度偏高;
b、没用少量蒸馏水洗涤烧杯和玻璃棒2~3次并转入容量瓶,会导致溶质的物质的量偏小,溶液浓度偏低;
c、加蒸馏水时,不慎超过了刻度线,导致溶液体积偏大,溶液浓度偏低;
d、砝码上沾有杂质,会导致溶质的质量偏大,溶液浓度偏高;
e、容量瓶使用前内壁沾有水珠,不影响溶质的物质的量和对溶液的体积,对溶液浓度无影响;
ad正确,故答案为:ad;
(5)检验沉淀是否洗涤干净,检验洗涤液中不含Cl-即可,因为氯化钠和硝酸银反应生成氯化银沉淀和硝酸钠,所以如果最后一次的洗涤液仍然有氯化钠,加入硝酸银溶液就会出现沉淀,反之说明溶液中没有氯化钠,故答案为:取少量最后一次的洗涤液于试管中,向试管中溶液加适量AgNO3溶液,如未出现白色沉淀说明已洗净;
(6)6.40g Fe2O3的物质的量为![]() =0.04mol,28.7 gAgCl的物质的量为
=0.04mol,28.7 gAgCl的物质的量为![]() =0.2mol,设FeCl3和FeCl2的物质的量分别为amol和bmol,由Fe原子个数守恒可得a+b=0.08①,由Cl原子个数守恒可得3a+2b=0.2②,解联立方程式可得a=b=0.04mol,则FeCl2的质量为0.04mol×127g/mol=5.08g,故答案为:5.08。
=0.2mol,设FeCl3和FeCl2的物质的量分别为amol和bmol,由Fe原子个数守恒可得a+b=0.08①,由Cl原子个数守恒可得3a+2b=0.2②,解联立方程式可得a=b=0.04mol,则FeCl2的质量为0.04mol×127g/mol=5.08g,故答案为:5.08。


 桃李文化快乐暑假武汉出版社系列答案
桃李文化快乐暑假武汉出版社系列答案 优秀生快乐假期每一天全新寒假作业本系列答案
优秀生快乐假期每一天全新寒假作业本系列答案 暑假接力赛新疆青少年出版社系列答案
暑假接力赛新疆青少年出版社系列答案科目:高中化学 来源: 题型:
【题目】在t℃时,Ag2CrO4(橘红色)在水溶液中的沉淀溶解平衡曲线如图所示.又知AgCl的Ksp=1.8×10-10。下列说法不正确的是( )

A. t℃时,Y点和Z点时Ag2CrO4的Ksp相等
B. 饱和Ag2CrO4溶液中加入K2CrO4不能使溶液由Y点变为X点
C. t℃时,Ag2CrO4的Ksp为1×10-8
D. t℃时,将0.01mol·L-1 AgNO3溶液滴入20mL0.01mol·L-1 KCl和0.01mol·L-1 K2CrO4的混合溶液中,Cl-先沉淀
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】设NA表示阿伏伽德罗常数的值。下列说法正确的是
A.由H218O与D216O组成的2.0g物质中所含中子、电子数均为NA
B.0.1molFe分别与足量的盐酸和氯气反应,转移的电子数均为0.2NA
C.0.1molAl与足量NaOH溶液反应,生成氢分子数为0.3NA
D.25℃,将0.1molCH3COONa加入稀醋酸至溶液呈中性时,溶液中CH3COO-数小于0.1NA
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】按照如图所示装置进行实验,填写有关现象及化学方程式。
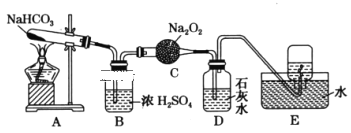
(1)A中现象是___。
(2)B中浓硫酸的作用是___。
(3)C中发生反应的化学方程式为___。
(4)D中的现象是___,发生反应的离子方程式是___。
(5)E中收集的气体是___(填名称)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列反应中,电子转移发生在不同物质的同种元素之间的是
A.2H2S + SO2=3S↓ + 2H2O
B.2KMnO4![]() K2MnO4+MnO2+O2↑
K2MnO4+MnO2+O2↑
C.2KClO3![]() 2KCl + 3O2↑
2KCl + 3O2↑
D.CuO + H2SO4=CuSO4 + H2O
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某强酸性溶液X中可能含有Fe2+、Fe3+、Al3+、Ba2+、NH4+、CO32-、NO3-、SO42-、SiO32-中的若干种,现取X溶液进行连续实验,实验过程及产物如图所示。实验过程中有一种气体为红棕色。
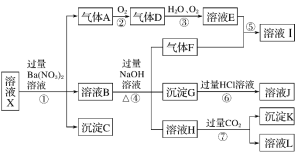
根据以上信息,回答下列问题:
(1)由强酸性条件即可判断X溶液中肯定不存在的离子有________
(2)溶液X中关于硝酸根离子的判断,正确的是______(填编号,下同)。
a.一定含有 b.一定不含有 c.可能含有
(3)化合物I中含有的化学键类型有____________
(4)转化⑦的离子方程式为____________
(5)对不能确定是否存在的离子,可以另取X溶液,加入下列溶液中的一种,根据现象即可判断,该试剂最好是________。
①NaOH溶液 ②KSCN溶液 ③氯水和KSCN的混合溶液 ④pH试纸 ⑤KMnO4溶液
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列有关实验的选项正确的是 ( )
A.  X若为苯,可用于吸收NH3或HCl,并防止倒吸
X若为苯,可用于吸收NH3或HCl,并防止倒吸
B. 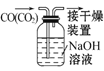 除去CO中的CO2
除去CO中的CO2
C.  可用于分离C2H5OH和H2O的混合物
可用于分离C2H5OH和H2O的混合物
D. 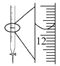 记录滴定终点读数为12.20 mL
记录滴定终点读数为12.20 mL
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某城市对大气进行监测,发现该市首要污染物为可吸入颗粒物PM2.5(直径小于等于25μm的悬浮颗粒物),其主要来源为燃煤、机动车尾气等。因此,对PM2.5、SO2、NOx等进行研究具有重要意义。请回答下列问题:
(1)PM2.5分散在空气中形成的分散系___(填“属于”,“不属于”)胶体。
(2)将PM2.5样本用蒸馏水处理制成待测试样。若测得该试样所含水溶性无机离子的化学组分及其平均浓度如下表:
离子 | K+ | Na+ | NH4+ | SO42- | NO3- | Cl- |
浓度(mol/L) | 4×10-6 | 6×10-6 | 2×10-5 | 4×10-5 | 3×10-5 | 2×10-5 |
根据表中数据判断待测试样为___(填酸”、“碱”)性,表示该试样酸碱性的c(H+)或c(OH-)=_______mol/L。
(3)煤燃烧排放的烟气含有SO2和NOx,形成酸雨,污染大气,采用NaClO2溶液在碱性条件下可对烟气进行脱硫,脱硝,效果非常好。完成下列对烟气脱硝过程的离子方程式。
___ClO2-+__NO+____=___Cl-+___NO3-+___,________________
(4)为减少SO2的排放,常采取的措施有:
①将煤转化为清洁气体燃料。写出焦炭与水蒸气反应的化学方程式___________。
②洗涤含SO2的烟气。以下物质可作洗涤剂的是___________。
a.Ca(OH)2 b.Na2CO3 c.CaCl2 d.NaHSO3
(5)汽车尾气中NOx和CO的生成及转化。
①汽车启动后,汽缸温度越高,单位时间内NO排放量越大,写出汽缸中生成NO化学方程式_______________。
②汽车燃油不完全燃烧时产生CO,目前,在汽车尾气系统中装置催化转化器可减少CO和NO的污染,其化学反应方程式为_______________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列实验中,实验设计或所选装置合理的是( )
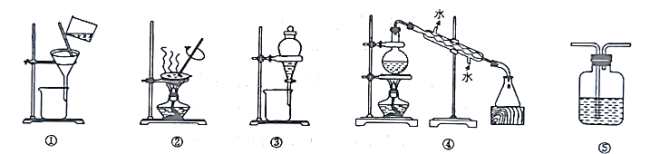
A.用乙醇提取碘水中的碘,应选择图③所示装置
B.用图①和图②所示装置进行粗盐提纯
C.用图④所示装置进行石油分馏实验制取汽油
D.图⑤所示装置中盛有饱和![]() 溶液,用于除去
溶液,用于除去![]() 中含有的少量
中含有的少量![]()
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com