
����Ŀ��ijǿ������ҺX�п��ܺ���Fe2����Fe3����Al3����Ba2����NH4+��CO32-��NO3-��SO42-��SiO32-�е������֣���ȡX��Һ��������ʵ�飬ʵ����̼�������ͼ��ʾ��ʵ���������һ������Ϊ����ɫ��
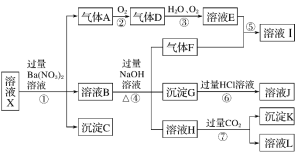
����������Ϣ���ش��������⣺
(1)��ǿ�������������ж�X��Һ�п϶������ڵ�������________
(2)��ҺX�й�����������ӵ��жϣ���ȷ����______(���ţ���ͬ)��
a��һ������ ��b��һ�������� ������c�����ܺ���
(3)������I�к��еĻ�ѧ��������____________
(4)ת���ߵ����ӷ���ʽΪ____________
(5)�Բ���ȷ���Ƿ���ڵ����ӣ�������ȡX��Һ������������Һ�е�һ�֣����������жϣ����Լ������________��
��NaOH��Һ����KSCN��Һ������ˮ��KSCN�Ļ����Һ����pH��ֽ����KMnO4��Һ
���𰸡�CO32-��SiO32- b ���ۼ������Ӽ� AlO2-��2H2O��CO2=HCO3-��Al(OH)3�� ��
��������
ǿ������Һ��һ��������CO32-��SiO32-������������ᱵ���ɳ�������ó���ΪBaSO4������˵��ԭ��Һ�к���SO42-���ӣ���Һ�д���SO42-����һ�������ں���������ӷ�Ӧ��Ba2+��C��BaSO4���������ᱵ��������A������A����������Ӧ��������D��D��H2O��O2���õ���ҺE�����ʵ���������һ������Ϊ����ɫ����ԭ��Һ�д���Fe2+������A��NO��DΪNO2��EΪ���������������������Ӿ���ǿ�����ԣ���������Һ��Fe2+��NO3-���ܹ��棬ԭ��Һ�в�����NO3-����ҺB�м����������������Һʱ����������F����ԭ��Һ�к���NH4+��F��NH3��NH3�����ᷴӦ��������泥�IΪ����泥�������ҺB�д���Fe3+�������G��Fe��OH��3����ҺH��ͨ�����������̼���ɳ���������ҺH�к���ƫ�������ԭ��Һ�д���Al3+������K��Al��OH��3����ҺL��NaHCO3������ҺX�п϶����е�������Al3+��SO42-��NH4+��Fe2+������ȷ���Ƿ���Fe3+��һ��������Ba2+��CO32-��SiO32-��NO3-��
��1��ǿ������Һ��һ���������CO32-��SiO32-���ʴ�Ϊ��CO32-��SiO32-��
��2���������ᱵ�������壬��ԭ��Һ�д���Fe2+��������������������Ӿ���ǿ�����ԣ���������Һ��Fe2+��NO3-���ܹ��棬ԭ��Һ�в�����NO3-����ѡb���ʴ�Ϊ��b��
��3��������IΪ����泥������Ϊ���ӻ�����������Ӽ����ۼ����ʴ�Ϊ�����ۼ������Ӽ���
��4��ת����Ϊƫ��������Һ�����������̼��Ӧ������������������̼�����ƣ���Ӧ�����ӷ���ʽΪAlO2-��2H2O��CO2=HCO3-��Al(OH)3�����ʴ�Ϊ��AlO2-��2H2O��CO2=HCO3-��Al(OH)3����
��5����Һ�в���ȷ���Ƿ���Fe3+����Ҫȷ��Fe3+���ڣ���õIJ��������ǣ�ȡԭ��Һ�������Թ��У����뼸��KSCN��Һ������Һ��Ϊ��ɫ����֤������Fe3+����֮���ޣ���ѡ�ڣ��ʴ�Ϊ���ڡ�


 �Ķ��쳵ϵ�д�
�Ķ��쳵ϵ�д�
| �꼶 | ���пγ� | �꼶 | ���пγ� |
| ��һ | ��һ��ѿγ��Ƽ��� | ��һ | ��һ��ѿγ��Ƽ��� |
| �߶� | �߶���ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
| ���� | ������ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��ij��ȤС��̽��Ba(OH)2��Һ�� H2SO4��Һ�����������ӷ�Ӧ����Ƶ�ʵ��װ�ú�ʵ��ⶨ�ĵ��������߷ֱ���ͼ��ʾ�������й�˵���������
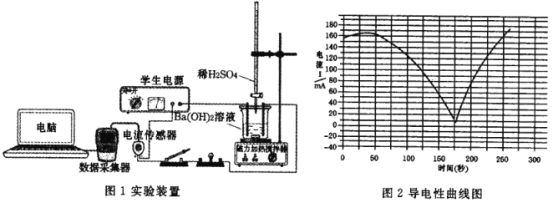
A.�÷�Ӧ�����ӷ���ʽ�� Ba2+ +2OH- +SO42-+2H+=BaSO4��+ 2H2O
B.ʵ������е��ݵ����ȷ����仯����˵���÷�ӦΪ���ӷ�Ӧ
C.����������͵��ʾ Ba(OH)2 ��Һ�� H2SO4��Һǡ����ȫ��Ӧ
D.���������H2SO4��Һ����õĵ��������ߺ�����������ͬ
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
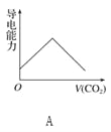
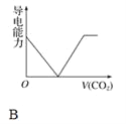
����Ŀ�����ӵ�Ħ���絼�ʿ����������������Һ�����ӵ���������ǿ����Ħ���絼��Խ����������Һ�еĵ�������Խǿ����֪Ca2����OH����HCO3����Ħ���絼�ʷֱ�Ϊ0.60��1.98��0.45���ݴ˿��жϣ��͵ij���ʯ��ˮ��ͨ������Ķ�����̼����Һ���������������̼ͨ�����ı仯������ȷ����(����)

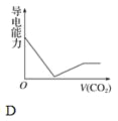
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ�����з�Ӧ�������ӷ���ʽ2H+ + CO32����CO2�� + H2O��ʾ����
A.HCl��Һ��MgCO3��Ӧ
B.CH3COOH��K2CO3��Һ��Ӧ
C.HNO3��Һ��NaHCO3��Һ��Ӧ
D.H2SO4��Һ��(NH4)2CO3��Һ��Ӧ
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ������һ�ݺ���FeCl3��FeCl2�Ĺ������ij��ѧ��ȤС��Ϊ�ⶨ���ɷֵĺ���������������ʵ�飺
ʵ��1 �ٳ�ȡһ����������Ʒ������Ʒ�ܽ⣻
�����ܽ�����Һ�м���������AgNO3��Һ������������
�۽��������ˡ�ϴ�ӡ�����õ���ɫ����28.7 g
ʵ��2 �ٳ�ȡ��ʵ��1����ͬ��������Ʒ���ܽ⣻
�����ܽ�����Һ��ͨ��������Cl2��
�������������Һ�м���������NaOH��Һ���õ����ɫ������
�ܽ��������ˡ�ϴ�Ӻ������յ��������ټ��٣��õ�����Fe2O36.40g
����ʵ��ش��������⣺
��1���ܽ���������õ��IJ���������________
��2��ʵ���ұ���FeCl2��Һʱͨ���������м������������ۣ���������_________
��3���û�ѧ����ʽ��ʾʵ��2�IJ������ͨ������Cl2�ķ�Ӧ��___________
��4��������ƿ����ʵ�����õ�NaOH��Һ�����������ʹ������ҺŨ��ƫ�ߵ���(�����)_______��
a��δ��ȴ��Һֱ��ת��
b��û����������ˮϴ���ձ��Ͳ�����2��3�β�ת������ƿ
c��������ˮʱ�����������˿̶���
d��������մ������
e������ƿʹ��ǰ�ڱ�մ��ˮ��
��5������ʵ��2�IJ�����г���ϴ�Ӹɾ��ķ�����___________
��6����С��ÿ�γ�ȡ����Ʒ�к���FeCl2������Ϊ_________g
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ���ƶ����Ľṹ��ʽ��ͼ������˵������ȷ����
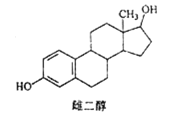
A. ���� Na��NaOH��Һ��Na2CO3��Һ��Ӧ
B. �ܷ����ӳɷ�Ӧ��ȡ����Ӧ����ȥ��Ӧ
C. �÷���������̼ԭ�Ӳ�������ͬһ��ƽ����
D. ���� FeC13��Һ������ɫ��Ӧ�������ܷ���������Ӧ
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��(1)3.01��1023��NH4+�������ӵ����ʵ�����______mol�����е��ӵ����ʵ�����______mol��
(2)200mL 2mol/L��Al2(SO4)3 ��Һ��SO42-�����ʵ���Ũ��Ϊ_________��
(3)��״����36g H2��O2��ɵĻ������������67.2L �������ֻ��������H2��O2�������Ϊ____________��
(4)ͬ��ͬѹ�£�������Ϊ17��48��NH3��CH4�������壬�ܶ�֮��Ϊ_________��
(5)��֪1.505��1023��A�����������Ϊ31g ����A�����Ħ��������_________��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��X��Y��Z��W ��Ϊ���������ڷǽ���Ԫ�أ������£�������⻯��ˮ��Һ(Ũ�Ⱦ�Ϊ0.01 mol/L)�� pH ��ԭ�Ӱ뾶�Ĺ�ϵ��ͼ��ʾ������ X Ϊ��Ԫ�ء������й�˵����ȷ����
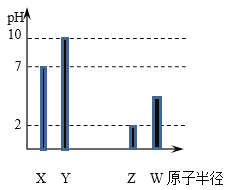
A.Y ����Ԫ��
B.ͼ�� Y ���⻯�ﲻ����X ���⻯�ﷴӦ
C.Z ������������Ӧˮ����Ļ�ѧʽΪ HClO4
D.W ������������Ӧˮ����������
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
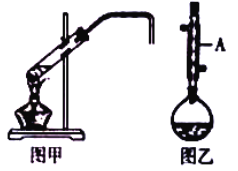
����Ŀ����ѧʵ��С������ʵ�����Ʊ������飨ͼ�ף���1���嶡�飨ͼ�ң����漰��ѧ��Ӧ���£�
NaBr+H2SO4�THBr+NaHSO4 ��
C2H5��OH+HBrC2H5��Br+H2O ��
CH3CH2CH2CH2��OH+HBrCH3CH2CH2CH2��Br+H2O ��
���ܴ��ڵĸ���Ӧ�У�����Ũ����Ĵ�������ˮ����ϩ���ѣ�Br����Ũ��������ΪBr2�ȡ��й������б����£�
�Ҵ� | ������ | ������ | 1���嶡�� | |
�ܶ�/gcm��3 | 0.7893 | 1.4604 | 0.8098 | 1.2758 |
�е�/�� | 78.5 | 38.4 | 117.2 | 111.6 |
��ش��������⣺
��1��ͼ��������A������Ϊ_____��
��2���Ҵ��ķе����������ķе㣬��ԭ����_____��
��3����1���嶡��ֲ�Ʒ���ڷ�Һ©���м�ˮ�����ã�������_____����ϲ㡱�����²㡱���ֲ㡱����
��4���Ʊ������У������Ũ����������ϡ�ͣ���Ŀ����_____��������ĸ��
A�����ٸ�����ϩ���ѵ�����
B������Br2������
C������HBr�Ļӷ�
D��ˮ�Ƿ�Ӧ�Ĵ���
��5������ȥ������е���������Br2���������������ʺϵ���_____��������ĸ��
A��NaIB��NaOHC��NaHSO3D��KCl
��6���Ʊ������飨ͼ�ף�ʱ�����ñ߷�Ӧ����������ķ�������������_____�����Ʊ�1���嶡�飨ͼ�ң�ʱȴ���ܱ߷�Ӧ�����������ԭ����_____��
�鿴�𰸺ͽ���>>
����ѧУ��ѡ - ��ϰ���б� - �����б�
����ʡ������Υ���Ͳ�����Ϣ�ٱ�ƽ̨ | �����к���Ϣ�ٱ�ר�� | ����թƭ�ٱ�ר�� | ����ʷ���������к���Ϣ�ٱ�ר�� | ������Ȩ�ٱ�ר��
Υ���Ͳ�����Ϣ�ٱ��绰��027-86699610 �ٱ����䣺58377363@163.com