
【题目】雌二醇的结构简式如图,下列说法不正确的是
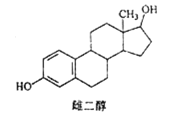
A. 能与 Na、NaOH溶液、Na2CO3溶液反应
B. 能发生加成反应、取代反应、消去反应
C. 该分子中所有碳原子不可能在同一个平面内
D. 可与 FeC13溶液发生显色反应,但不能发生氧化反应
 小学课时特训系列答案
小学课时特训系列答案科目:高中化学 来源: 题型:
【题目】(11分)有机物A(C10H20O2)具有兰花香味,可用作香皂、洗发香波的芳香赋予剂。已知:
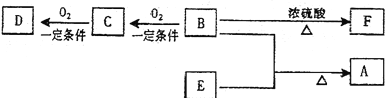
①B分子中没有支链。
②D能与碳酸氢钠溶液反应放出二氧化碳。
③D、E互为具有相同官能团的同分异构体。E分子烃基上的氢若被Cl取代,其一氯代物只有一种。
④F可以使溴的四氯化碳溶液褪色。
(1)B可以发生的反应有 (选填序号)
①取代反应 ②消去反应 ③加聚反应 ④氧化反应
(2)D、F分子所含的官能团的名称依次是: 、 。
(3)写出与D、E具有相同官能团的同分异构体的可能结构简式:
。
(4)E可用于生产氨苄青霉素等。已知E的制备方法不同于其常见的同系物,据报道,可由2—甲基—1—丙醇和甲酸在一定条件下制取E。该反应的化学方程式是 。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】碲(Te)元素是当今新材料的主要成分之一。工业上从电解法精炼铜的阳极泥中提取纯度较高的碲,经预处理后的阳极泥中含TeO2及铁、铅、铜的化合物等,通过以下流程得到:

已知:①TeO2是两性氧化物,微溶于水,可溶于强酸或强碱。
②部分难溶物的Ksp如表:
化合物 | Fe(OH)2 | Pb(OH)2 | Cu(OH)2 | FeS | PbS | CuS |
Ksp | 8×10-16 | 1.2×10-15 | 1.3×10-20 | 4×10-19 | 1×10-28 | 6×10-36 |
回答下列问题:
(1)“碱浸”时TeO2发生反应的化学方程式为___________。
(2)加入Na2S溶液的主要目的是___________。
(3)“沉碲”发生反应的化学方程式为_______。
(4)“酸溶”后,将SO2通入溶液中进行“还原”得到粗碲,该反应的化学方程式是___________。
(5)电解法提纯粗碲时,以Na2TeO3溶液为电解质溶液,阳极材料为___________。电解过程中阴极的电极反应式为___________。
(6)常温下,向0.lmol/LNa2TeO3溶液中滴加盐酸,当溶液pH=5时,溶液中c(TeO32-):c(H2TeO3)=___________。(已知:H2TeO3的Ka1=1.0×10-3Ka2=2.0×10-8)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】实验室需要0.5 mol/L H2SO4溶液500 mL。根据溶液的配制情况回答下列问题:

(1)如图所示的仪器中配制溶液肯定不需要的是________(填序号)。
(2)下列操作中,500ml容量瓶所不具备的功能有________(填序号)。
A.配制一定体积准确浓度的标准溶液 B.长期贮存溶液
C.用来加热溶解固体溶质 D.量取220 mL溶液
(3)实验中,其他操作均正确,若定容时仰视刻度线,则所配制溶液的浓度将____ 0.5mol/L(填“大于”“等于”或“小于”,下同)。若溶液未冷却即转移至容量瓶定容,则所配制溶液浓度将________0.5 mol/L。
(4)根据计算得知:所需质量分数为98%、密度为1.84 g/cm3的浓硫酸的体积为________mL(计算结果保留一位小数)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某强酸性溶液X中可能含有Fe2+、Fe3+、Al3+、Ba2+、NH4+、CO32-、NO3-、SO42-、SiO32-中的若干种,现取X溶液进行连续实验,实验过程及产物如图所示。实验过程中有一种气体为红棕色。
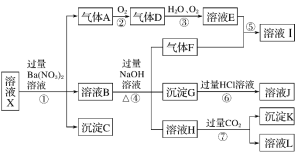
根据以上信息,回答下列问题:
(1)由强酸性条件即可判断X溶液中肯定不存在的离子有________
(2)溶液X中关于硝酸根离子的判断,正确的是______(填编号,下同)。
a.一定含有 b.一定不含有 c.可能含有
(3)化合物I中含有的化学键类型有____________
(4)转化⑦的离子方程式为____________
(5)对不能确定是否存在的离子,可以另取X溶液,加入下列溶液中的一种,根据现象即可判断,该试剂最好是________。
①NaOH溶液 ②KSCN溶液 ③氯水和KSCN的混合溶液 ④pH试纸 ⑤KMnO4溶液
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】25 ℃时,向Na2CO3溶液中滴入盐酸,混合溶液的pH与离子浓度变化的关系如图所示。

已知:lg X=lg c(CO32-)/c(HCO3-)或lg c(HCO3-)/c(H2CO3),下列叙述正确的是( )
A. 曲线m表示pH与c(HCO3-)/c(H2CO3)的变化关系
B. 当溶液呈中性时,c(Na+)=c(HCO3-)+2c(CO32-)
C. Ka1(H2CO3)=1.0×10-6.4
D. 25 ℃时,CO32-+H2O![]() HCO3-+OH-的平衡常数为1.0×10-7.6
HCO3-+OH-的平衡常数为1.0×10-7.6
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】实验室以一种工业废渣(主要成分为MgCO3、Mg2SiO4和少量Fe、Al的氧化物)为原料制备MgCO3·3H2O。实验过程如如:
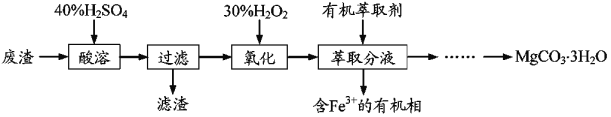
(1)酸溶过程中主要反应的热化学方程式为
MgCO3(s)+2H+(aq)=Mg2+(aq)+CO2(g)+H2O(l) ΔH=-50.4kJ·mol–1
Mg2SiO4(s)+4H+(aq)=2Mg2+(aq)+H2SiO3(s)+H2O(l) ΔH=-225.4kJ·mol–1
酸溶需加热的目的是__;所加H2SO4不宜过量太多的原因是__。
(2)加入H2O2氧化时发生发应的离子方程式为__。
(3)用如图所示的实验装置进行萃取分液,以除去溶液中的Fe3+。
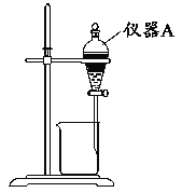
①实验装置图中仪器A的名称为__。
②为使Fe3+尽可能多地从水相转移至有机相,采取的操作:向装有水溶液的仪器A中加入一定量的有机萃取剂,__、静置、分液,并重复多次。
(4)请补充完整由萃取后得到的水溶液制备MgCO3·3H2O的实验方案:边搅拌边向溶液中滴加氨水,___,过滤、用水洗涤固体2~3次,在50℃下干燥,得到MgCO3·3H2O。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】ClO2作为一种广谱型的消毒剂,将逐渐用来取代Cl2成为自来水的消毒剂。已知ClO2是一种易溶于水而难溶于有机溶剂的气体,实验室制备ClO2的原理是用亚氯酸钠固体与氯气反应 :2NaClO2 + Cl2 ===2ClO2 + 2NaCl。
下图是实验室用于制备和收集一定量较纯净的ClO2的装置(某些夹持装置和垫持用品省略)。其中E中盛有CCl4液体(用于除去ClO2中的未反应的Cl2)。
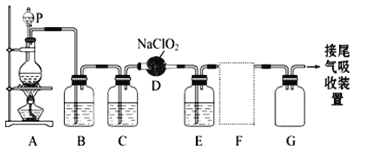
(1)仪器P的名称是_________________。
(2)写出装置A中烧瓶内发生反应的离子方程式:______________________________。
(3)B装置中所盛试剂是____________________。
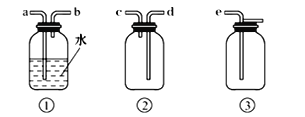
(4)F为ClO2收集装置,应选用的装置是___________(填序号),其中与E装置导管相连的导管口是__________(填接口字母)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】![]() 时,使用
时,使用![]() 调节溶液
调节溶液![]() 过程中,二元弱酸
过程中,二元弱酸![]() 溶液中含
溶液中含![]() 微粒的分布分数如图所示。下列叙述中正确的是( )
微粒的分布分数如图所示。下列叙述中正确的是( )
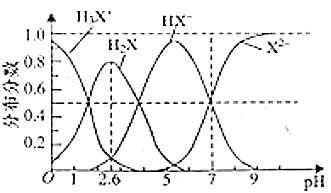
A.溶液![]() 由1升至2.6时主要存在的反应是
由1升至2.6时主要存在的反应是![]()
B.![]() 溶液中
溶液中![]()
C.![]()
D.溶液呈中性时,![]()
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com