
【题目】某兴趣小组探究Ba(OH)2溶液和 H2SO4溶液发生的是离子反应,设计的实验装置和实验测定的导电性曲线分别如图所示。下列有关说法错误的是
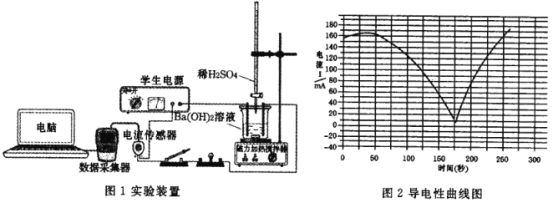
A.该反应的离子方程式是 Ba2+ +2OH- +SO42-+2H+=BaSO4↓+ 2H2O
B.实验过程中灯泡的亮度发生变化可以说明该反应为离子反应
C.导电能力最低点表示 Ba(OH)2 溶液和 H2SO4溶液恰好完全反应
D.用盐酸代替H2SO4溶液,测得的导电性曲线和上述曲线相同
【答案】D
【解析】
A. Ba(OH)2溶液和H2SO4溶液发生生成硫酸钡和水,离子方程式为:Ba2++2OH-+SO42-+2H+=BaSO4↓+2H2O,A项正确;
B. 导电能力约为0时,Ba(OH)2与硫酸反应恰好完全反应,溶液中几乎没有自由移动的离子,可以说明该反应为离子反应,B项正确;
C. 导电能力最低点,此时Ba(OH)2与硫酸反应恰好完全反应,溶液中几乎没有自由移动的离子,C项正确;
D. 用盐酸代替H2SO4溶液,发生的反应为:Ba(OH)2+2HCl= BaCl2+2H2O,其实质是OH-+H+= H2O,其导电能力不会降为0,可知测得的导电性曲线和上述曲线不相同,D项错误;
答案选D。


 阅读快车系列答案
阅读快车系列答案科目:高中化学 来源: 题型:
【题目】某同学在做实验时引发了镁失火,他立即拿起二氧化碳灭火器欲把火扑灭,却被实验老师及时制止。原因是CO2可以支持镁燃烧发生以下反应:2Mg+CO2![]() 2MgO+C,下列关于该反应的判断正确的是
2MgO+C,下列关于该反应的判断正确的是
A. Mg元素化合价由0价升高到+2价,所以MgO是还原产物
B. 由此反应可以判断氧化性CO2>MgO,还原性Mg>C
C. CO2作氧化剂,表现氧化性,发生氧化反应
D. Mg原子失去的电子数目等于O原子得到的电子数目
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列离子方程式正确的是( )
A. 铁与FeCl3溶液反应:Fe+Fe3+===2Fe2+
B. Fe与稀盐酸反应:2Fe+6H+===2Fe3++3H2↑
C. FeCl2溶液与Cl2反应:Fe2++Cl2===Fe3++2Cl-
D. Fe(OH)3与盐酸反应:Fe(OH)3+3H+===Fe3++3H2O
【答案】D
【解析】A、电荷不守恒,应为Fe+2Fe3+=3Fe2+,故A错误;B、违反反应事实,应为Fe+2H+=Fe2++H2↑,故B错误;C、电荷不守恒,应为2Fe2++Cl2=2Fe3++2Cl-,故C错误;D、氢氧化铁是难溶物质,不能拆写成离子,发生中和反应,故D正确。
点睛:离子反应方程式正误判断中,一先看是否符合客观事实,二看电荷数是否相等,三看拆写是否正确,四看是否缺少反应。
【题型】单选题
【结束】
6
【题目】把过量铁屑加入FeCl3、CuCl2的混合溶液中,反应结束后,称得剩余固体的质量与所加铁屑的质量相等。则原溶液中FeCl3与CuCl2的物质的量之比是( )
A.7∶2B.3∶2
C.2∶3D.2∶7
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】Na2S2O3可用于照相业作定影剂等。实验室可通过Na2S、Na2CO3和SO2共同反应来制备,装置如图。

(1)仪器a的名称为____。
(2)A装置中,NaOH溶液的作用是___。
(3)D中生成Na2S2O3的化学方程式为___。
(4)装置C的作用有___、观察SO2的生成速率。若观察到SO2的生成速率过快,应进行的操作是___。
(5)本实验所需的Na2S可由硫化钠碱坯(主要含Na2S,还含少量Na2SO4、炭粉等杂质)制备。
已知Na2S的溶解度、固相成分与温度的关系如表:
温度/℃ | 溶解度/g | 固相 |
-10 | 10.3 | Na2S·9H2O+冰 |
10 | 13.6 | Na2S·9H2O |
20 | 18.7 | Na2S·9H2O |
40 | 28.5 | Na2S·9H2O |
48 | 35.7 | Na2S·9H2O+Na2S·6H2O |
60 | 39.1 | Na2S·6H2O |
80 | 49.1 | Na2S·6H2O |
91.5 | 61.3 | Na2S·6H2O+Na2S·5.5H2O |
请补充完整由硫化钠碱坯制备Na2S·9H2O晶体的实验方案:边搅拌边将适量蒸馏水加入硫化钠碱坯中,过滤,__,得到Na2S·9H2O晶体(须用的试剂:BaS、无水乙醇)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在t℃时,Ag2CrO4(橘红色)在水溶液中的沉淀溶解平衡曲线如图所示.又知AgCl的Ksp=1.8×10-10。下列说法不正确的是( )

A. t℃时,Y点和Z点时Ag2CrO4的Ksp相等
B. 饱和Ag2CrO4溶液中加入K2CrO4不能使溶液由Y点变为X点
C. t℃时,Ag2CrO4的Ksp为1×10-8
D. t℃时,将0.01mol·L-1 AgNO3溶液滴入20mL0.01mol·L-1 KCl和0.01mol·L-1 K2CrO4的混合溶液中,Cl-先沉淀
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】(11分)有机物A(C10H20O2)具有兰花香味,可用作香皂、洗发香波的芳香赋予剂。已知:
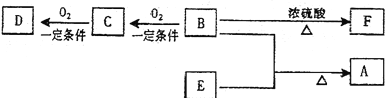
①B分子中没有支链。
②D能与碳酸氢钠溶液反应放出二氧化碳。
③D、E互为具有相同官能团的同分异构体。E分子烃基上的氢若被Cl取代,其一氯代物只有一种。
④F可以使溴的四氯化碳溶液褪色。
(1)B可以发生的反应有 (选填序号)
①取代反应 ②消去反应 ③加聚反应 ④氧化反应
(2)D、F分子所含的官能团的名称依次是: 、 。
(3)写出与D、E具有相同官能团的同分异构体的可能结构简式:
。
(4)E可用于生产氨苄青霉素等。已知E的制备方法不同于其常见的同系物,据报道,可由2—甲基—1—丙醇和甲酸在一定条件下制取E。该反应的化学方程式是 。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某无色的混合气体甲中可能含有NO2、NO、CO2、O2、NH3、N2中的几种,将100mL甲气体经过如图所示的实验装置进行处理,结果得到酸性溶液,而几乎无气体剩余,则甲气体的组成为(不考虑Na2O2与NO2、NO的反应)( )
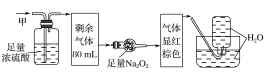
A.NO2、CO2、N2B.NH3、NO、CO2
C.NH3、N2、CO2D.NO、O2、NH3
【答案】B
【解析】
该气体无色,说明其中不含NO2;气体通过浓硫酸体积减小,说明其中有NH3;气体通过足量Na2O2后显红棕色,说明其中含有CO2和NO,故不含O2;最后通入水中无气体剩余,说明其中不存在N2,选项B正确,故答案为B。
【题型】单选题
【结束】
19
【题目】A、B、C、D是四种常见气体单质。E的相对分子质量比F小16,且F为红棕色。有关的转化关系如图所示(反应条件与部分反应的生成物略去)。
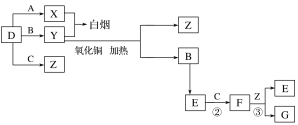
请回答下列问题:
(1)D的化学式为__,Y的化学式为__,E的化学式为__。
(2)Y与氧化铜反应,每生成1molB消耗3mol氧化铜,该反应的化学方程式为__。
(3)Y与E在一定条件下可反应生成B和Z,这是一个具有实际意义的反应,可消除E对环境的污染,该反应的化学方程式为__。
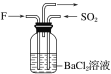
(4)气体F和气体SO2在通常条件下同时通入盛有BaCl2溶液的洗气瓶中(如图所示),洗气瓶中是否有沉淀生成?__,理由是__。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】燃烧0.1 mol某有机物得0.2 mol CO2和0.3 mol H2O,由此得出的结论不正确的是( )
A. 该有机物分子的结构简式为CH3—CH3
B. 该有机物中碳、氢元素原子数目之比为1∶3
C. 该有机物分子中不可能含有![]() 双键
双键
D. 该有机物分子中可能含有氧原子
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某强酸性溶液X中可能含有Fe2+、Fe3+、Al3+、Ba2+、NH4+、CO32-、NO3-、SO42-、SiO32-中的若干种,现取X溶液进行连续实验,实验过程及产物如图所示。实验过程中有一种气体为红棕色。
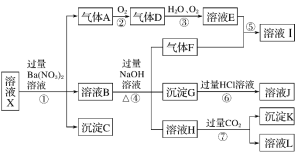
根据以上信息,回答下列问题:
(1)由强酸性条件即可判断X溶液中肯定不存在的离子有________
(2)溶液X中关于硝酸根离子的判断,正确的是______(填编号,下同)。
a.一定含有 b.一定不含有 c.可能含有
(3)化合物I中含有的化学键类型有____________
(4)转化⑦的离子方程式为____________
(5)对不能确定是否存在的离子,可以另取X溶液,加入下列溶液中的一种,根据现象即可判断,该试剂最好是________。
①NaOH溶液 ②KSCN溶液 ③氯水和KSCN的混合溶液 ④pH试纸 ⑤KMnO4溶液
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com