
ЁОЬтФПЁПЯТСаРызгЗНГЬЪНе§ШЗЕФЪЧ(ЁЁЁЁ)
A. ЬњгыFeCl3ШмвКЗДгІЃКFeЃЋFe3ЃЋ===2Fe2ЃЋ
B. FeгыЯЁбЮЫсЗДгІЃК2FeЃЋ6HЃЋ===2Fe3ЃЋЃЋ3H2Ёќ
C. FeCl2ШмвКгыCl2ЗДгІЃКFe2ЃЋЃЋCl2===Fe3ЃЋЃЋ2ClЃ
D. Fe(OH)3гыбЮЫсЗДгІЃКFe(OH)3ЃЋ3HЃЋ===Fe3ЃЋЃЋ3H2O
ЁОД№АИЁПD
ЁОНтЮіЁПAЁЂЕчКЩВЛЪиКуЃЌгІЮЊFe+2Fe3+=3Fe2+ЃЌЙЪAДэЮѓЃЛBЁЂЮЅЗДЗДгІЪТЪЕЃЌгІЮЊFe+2H+=Fe2++H2ЁќЃЌЙЪBДэЮѓЃЛCЁЂЕчКЩВЛЪиКуЃЌгІЮЊ2Fe2++Cl2=2Fe3++2Cl-ЃЌЙЪCДэЮѓЃЛDЁЂЧтбѕЛЏЬњЪЧФбШмЮяжЪЃЌВЛФмВ№аДГЩРызгЃЌЗЂЩњжаКЭЗДгІЃЌЙЪDе§ШЗЁЃ
ЕуОІЃКРызгЗДгІЗНГЬЪНе§ЮѓХаЖЯжаЃЌвЛЯШПДЪЧЗёЗћКЯПЭЙлЪТЪЕЃЌЖўПДЕчКЩЪ§ЪЧЗёЯрЕШЃЌШ§ПДВ№аДЪЧЗёе§ШЗЃЌЫФПДЪЧЗёШБЩйЗДгІЁЃ
ЁОЬтаЭЁПЕЅбЁЬт
ЁОНсЪјЁП
6
ЁОЬтФПЁПАбЙ§СПЬњаММгШыFeCl3ЁЂCuCl2ЕФЛьКЯШмвКжаЃЌЗДгІНсЪјКѓЃЌГЦЕУЪЃгрЙЬЬхЕФжЪСПгыЫљМгЬњаМЕФжЪСПЯрЕШЁЃдђдШмвКжаFeCl3гыCuCl2ЕФЮяжЪЕФСПжЎБШЪЧЃЈ ЃЉ
A.7ЁУ2B.3ЁУ2
C.2ЁУ3D.2ЁУ7
ЁОД№АИЁПD
ЁОНтЮіЁП
ИљОнЗДгІЂй2Fe3ЃЋЃЋFe=3Fe2ЃЋПЩжЊЃЌЬњШмНтЃЌЙЬЬхжЪСПМѕЩйЃЌИљОнЗДгІЂкCu2ЃЋЃЋFe=CuЃЋFe2ЃЋПЩжЊЃЌЬњШмНтЃЌЭЮіГіЃЌЙЬЬхжЪСПдіМгЃЌЖјЗДгІНсЪјКѓЃЌГЦЕУЪЃгрЙЬЬхжЪСПгыЫљМгЬњаМЕФжЪСПЯрЕШЃЌдђЗДгІЂйжаЙЬЬхМѕЩйЕФжЪСПгыЗДгІЂкжаЙЬЬхдіМгЕФжЪСПЯрЕШЃЌМД56 gЁЄmolЃ1ЁС![]() ЃН(64gЁЄmolЃ1Ѓ56gЁЄmolЃ1)ЁСn(Cu2ЃЋ)ЃЌЕУn(Fe3ЃЋ)ЁУn(Cu2ЃЋ)ЃН2ЁУ7ЃЌЙЪn(FeCl3)ЁУn(CuCl2)ЃН2ЁУ7ЃЌЙЪД№АИЮЊDЁЃ
ЃН(64gЁЄmolЃ1Ѓ56gЁЄmolЃ1)ЁСn(Cu2ЃЋ)ЃЌЕУn(Fe3ЃЋ)ЁУn(Cu2ЃЋ)ЃН2ЁУ7ЃЌЙЪn(FeCl3)ЁУn(CuCl2)ЃН2ЁУ7ЃЌЙЪД№АИЮЊDЁЃ



| ФъМЖ | ИпжаПЮГЬ | ФъМЖ | ГѕжаПЮГЬ |
| ИпвЛ | ИпвЛУтЗбПЮГЬЭЦМіЃЁ | ГѕвЛ | ГѕвЛУтЗбПЮГЬЭЦМіЃЁ |
| ИпЖў | ИпЖўУтЗбПЮГЬЭЦМіЃЁ | ГѕЖў | ГѕЖўУтЗбПЮГЬЭЦМіЃЁ |
| ИпШ§ | ИпШ§УтЗбПЮГЬЭЦМіЃЁ | ГѕШ§ | ГѕШ§УтЗбПЮГЬЭЦМіЃЁ |
ПЦФПЃКИпжаЛЏбЇ РДдДЃК ЬтаЭЃК
ЁОЬтФПЁПЮЊЬсДПЯТСаЮяжЪЃЈРЈКХФкЮЊдгжЪЃЉЃЌЫљгУЕФГ§дгЪдМСКЭЗжРыЗНЗЈОље§ШЗЕФвЛзщЪЧ
бЁЯю | Д§ЬсДПЕФЮяжЪ | Г§дгЪдМС | ЗжРыЗНЗЈ |
A | Cl2ЃЈH2OЃЉ | БЅКЭNaClШмвК | ЯДЦј |
B | CH3CH2OHЃЈH2OЃЉ | CaO | еєСѓ |
C | FeCl2ЃЈFeCl3ЃЉ | Cu | Й§ТЫ |
D |
| CCl4 | нЭШЁ |
A.AB.BC.CD.D
ВщПДД№АИКЭНтЮі>>
ПЦФПЃКИпжаЛЏбЇ РДдДЃК ЬтаЭЃК
ЁОЬтФПЁПИљОнБэжааХЯЂХаЖЯЃЌЯТСабЁЯюВЛе§ШЗЕФЪЧ(ЁЁЁЁ)
ађКХ | ЗДгІЮя | ВњЮя |
Ђй | KMnO4ЁЂH2O2ЁЂH2SO4 | K2SO4ЁЂMnSO4 |
Ђк | Cl2ЁЂFeBr2 | FeCl3ЁЂFeBr3 |
Ђл | MnO | Cl2ЁЂMn2ЃЋ |
A. ЕкЂйзщЗДгІЕФЦфгрВњЮяЮЊH2OКЭO2
B. ЕкЂкзщЗДгІжаВЮМгЗДгІЕФCl2гыFeBr2ЕФЮяжЪЕФСПжЎБШЮЊ1ЁУ2
C. ЕкЂлзщЗДгІжаЩњГЩ1 mol Cl2ЃЌзЊвЦЕчзг 2 mol
D. бѕЛЏадгЩЧПЕНШѕЫГађЮЊMnO![]() ЃОCl2ЃОFe3ЃЋЃОBr2
ЃОCl2ЃОFe3ЃЋЃОBr2
ВщПДД№АИКЭНтЮі>>
ПЦФПЃКИпжаЛЏбЇ РДдДЃК ЬтаЭЃК
ЁОЬтФПЁПВшвЖжаЕФВшЖрЗгЪЧвЛжжЬьШЛПЙбѕЛЏМСЃЈЦфПЙбѕЛЏФмСІЪЧVCЕФ5ЁЋ10БЖЃЉЃЌЫќвзШмгкЮТЫЎ(40ЁцЁЋ80Ёц)ЁЂввДМЁЂввЫсввѕЅЃЌФбШмгкТШЗТЃЈТШЗТЭЈГЃЪЧЮоЩЋвКЬхЃЌВЛШмгкЫЎЃЌУмЖШдМЮЊЫЎЕФ1.5БЖЃЉЁЃФГЪЕбщаЁзщЩшМЦШчЭМЪЕбщСїГЬДгВшвЖжаЬсШЁВшЖрЗгЃК
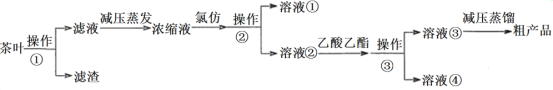
ЧыЛиД№ЯТСаЮЪЬтЃК
ЃЈ1ЃЉЂйНЋВшвЖЗлЫщЕФФПЕФЪЧ____________ЁЃ
ЂкгУЫЎНўШЁВшЖрЗгЪБЃЌЪЕбщаЁзщЗЂЯжНСАшЫйЖШдНПьЃЌВшЖрЗгНўГіТЪЯТНЕЃЌПЩФмдвђЪЧ_______ЁЃ
ЃЈ2ЃЉЯТСагаЙиЪЕбщЛљБОВйзїе§ШЗЕФЪЧ________ЁЃ
AЃЎВйзїЂйЙ§ТЫЪБЃЌПЩгУВЃСЇАєЪЪЕБНСАшвдМгПьЗжРыЫйЖШ
BЃЎЗжвКТЉЖЗЪЙгУЧАаыМьбщЪЧЗёТЉЫЎВЂЯДОЛБИгУ
CЃЎнЭШЁЙ§ГЬжаЃЌОеёвЁВЂЗХЦјКѓЃЌНЋЗжвКТЉЖЗжУгкЬњШІЩЯСЂМДЗжвК
DЃЎВйзїЂлЗжвКЪБЃЌШмвКЂмгІИУДгЗжвКТЉЖЗЯТПкЗХГі
ЃЈ3ЃЉВЩгУМѕбЙеєЗЂЕФРэгЩЪЧ____________ЁЃ
ЃЈ4ЃЉШмвКЂйдкЗжвКТЉЖЗЕФ_______ЃЈЬюЁАЩЯЁБЛђЁАЯТЁБЃЉВуЁЃ
ЃЈ5ЃЉЮЊСЫНјвЛВНЖдДжВњЦЗНјааЬсДПЃЌПЩвдВЩгУЕФЬсДПЗНЗЈЪЧ_____________ЁЃ
ЃЈ6ЃЉдкЫсадНщжЪжаЃЌВшЖрЗгФмНЋFe3+ЛЙдЮЊFe2+ЃЌFe2+гыK3Fe(CN)6ЩњГЩЕФЩюРЖЩЋХфЮЛЛЏКЯЮяKFe[Fe(CN)6]ЖдЬиЖЈВЈГЄЙтЕФЮќЪеГЬЖШ(гУЙтУмЖШжЕAБэЪО)гыВшЖрЗгдквЛЖЈХЈЖШЗЖЮЇФкГЩе§БШЁЃAгыВшЖрЗгБъзМвКХЈЖШЕФЙиЯЕШчЭМЫљЪОЃК
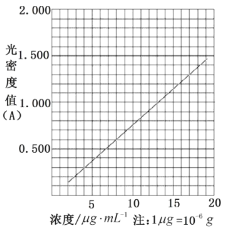
ГЦШЁ2.00gДжВњЦЗЃЌгУеєСѓЫЎШмНтВЂЖЈШнжС1000mLЃЌвЦШЁИУШмвК1.00 mLЃЌМгЙ§СПFe3+КЭK3Fe(CN)6ЫсадШмвКЃЌгУеєСѓЫЎЖЈШнжС100mLКѓЃЌВтЕУШмвКЙтУмЖШжЕA=1.200ЃЌОЙ§МЦЫуВњЦЗЕФДПЖШЪЧ_______ЃЈвджЪСПЗжЪ§БэЪОЃЌБЃСєжСаЁЪ§ЕуКѓвЛЮЛЃЉЁЃ
ВщПДД№АИКЭНтЮі>>
ПЦФПЃКИпжаЛЏбЇ РДдДЃК ЬтаЭЃК
ЁОЬтФПЁПЯТСаЗДгІЕФРызгЗНГЬЪНе§ШЗЕФЪЧЃЈ ЃЉ
A.Al2O3ШмгкNaOHШмвКЃКAl2O3+2OH-=2AlO2-+2H2O
B.AgNO3ШмвКжаМгШыЙ§СПАБЫЎЃКAg++NH3ЁЄH2O=AgOHЁ§+NH4+
C.гУЖшадЕчМЋЕчНт0.1molЁЄL-1CuCl2ШмвКЃК2Cl-+2H2O![]() H2Ёќ+Cl2Ёќ+2OH-
H2Ёќ+Cl2Ёќ+2OH-
D.Й§СПNaHCO3ШмвККЭГЮЧхЪЏЛвЫЎЛьКЯЃКCa2++HCO![]() +OH-=CaCO3Ё§+H2O
+OH-=CaCO3Ё§+H2O
ВщПДД№АИКЭНтЮі>>
ПЦФПЃКИпжаЛЏбЇ РДдДЃК ЬтаЭЃК
ЁОЬтФПЁПгУШчЭМЫљЪОзАжУНјааЯТСаЪЕбщЃКНЋЂйжаЕФХЈСђЫсЕЮШыЂкжаЃЌдЄВтЕФЯжЯѓгыНсТлЯрЗћЕФЪЧЃЈ ЃЉ
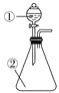
A. ШєЂкЮЊХЈбЮЫсЃЛВњЩњДѓСПЦјЬхВњЩњЃЛЫЕУїСђЫсЕФЫсадБШбЮЫсЧП
B. ШєЂкЮЊЭЦЌЃЛгаЦјХнВњЩњЃЌЕзВПЩњГЩЛвАзЩЋЙЬЬхЃЛЫЕУїХЈСђЫсгаЧПбѕЛЏад
C. ШєЂкЮЊРЖЩЋСђЫсЭОЇЬхЃЛРЖЩЋОЇЬхБфЮЊАзЩЋЃЛЫЕУїХЈСђЫсгаЮќЫЎадЃЌЗЂЩњЮяРэБфЛЏ
D. ШєЂкЮЊесЬЧЃЛАзЩЋЙЬЬхБфЮЊКкЩЋКЃУрзДЃЌгаЦјЬхЗХГіЃЛЫЕУїХЈСђЫсгаЭбЫЎадЁЂбѕЛЏад
ЁОД№АИЁПD
ЁОНтЮіЁП
A.ХЈСђЫсОпгаЮќЫЎад,ХЈбЮЫсОпгаЛгЗЂад,ХЈСђЫсЮќЪеХЈбЮЫсжаЕФЫЎЗжЕМжТХЈбЮЫсХЈЖШдіДѓЖјМгЧПЦфЛгЗЂад,ХЈСђЫсКЭбЮЫсЖМЪЧЧПЫс,ИУЪЕбщЬхЯжХЈбЮЫсЕФЛгЗЂадКЭХЈСђЫсЕФЮќЫЎад,ЙЪAДэЮѓЁЃ
B.ГЃЮТЯТХЈСђЫсКЭCuВЛЗДгІ,ЫљвдУЛгаУїЯдЯжЯѓ,ЙЪBДэЮѓЁЃ
C.ХЈСђЫсОпгаЮќЫЎад,ФмЮќЪеЮхЫЎСђЫсЭжаЕФНсОЇЫЎЖјЪЙЮхЫЎСђЫсЭБфЮЊЮоЫЎСђЫсЭ,ЙЬЬхгЩРЖЩЋБфЮЊАзЩЋЃЌИУЪЕбщЮЊЛЏбЇБфЛЏЃЌЙЪCДэЮѓЁЃ
D.ХЈСђЫсФмНЋгаЛњЮяжаЕФHЁЂ0дЊЫивд2:1ЫЎЕФаЮЪНЭбШЅЖјЬхЯжЭбЫЎад,ЛЙФмНЋесЬЧЭбЫЎКѓаЮГЩЕФЬМЕЅжЪ. бѕЛЏЮЊЖўбѕЛЏЬМ.ЭЌЪБЛЙЩњГЩДЬМЄадЦјЮЖЕФЖўбѕЛЏСђЃЌЬхЯжСЫХЈСђЫсЕФЧПбѕЛЏад.ЙЪDе§ШЗЁЃ
Д№АИбЁDЁЃ
ЁОЬтаЭЁПЕЅбЁЬт
ЁОНсЪјЁП
9
ЁОЬтФПЁПвбжЊNH4NO3дкПеЦјжаБЌеЈЪБЕФЗДгІЮЊ4NH4NO3![]() 3N2ЁќЃЋ2NO2ЁќЃЋ8H2OЁќЁЃЯТСаЫЕЗЈВЛе§ШЗЕФЪЧЃЈ ЃЉ
3N2ЁќЃЋ2NO2ЁќЃЋ8H2OЁќЁЃЯТСаЫЕЗЈВЛе§ШЗЕФЪЧЃЈ ЃЉ
A.NH4NO3дкИпЮТЯТБЌеЈЪБПЩвдПДЕНКьзиЩЋЕФбЬЮэ
B.NH4NO3ЕФКЌЕЊСПаЁгкТШЛЏяЇ
C.ЪЕбщЪвВЛФмгУNH4NO3ЙЬЬхгыCa(OH)2ЙЬЬхЛьКЯМгШШжЦБИNH3
D.ГЫзјЛ№ГЕЪБВЛФмаЏДјNH4NO3ЙЬЬх
ВщПДД№АИКЭНтЮі>>
ПЦФПЃКИпжаЛЏбЇ РДдДЃК ЬтаЭЃК
ЁОЬтФПЁПЯТСагаЙиЛЏбЇЗћКХБэеїе§ШЗЕФЪЧ
A. ЕчНтЗЈОЋСЖЭЃЌвѕМЋЕчМЋЗДгІЃКCu2++2eЃ== Cu
B. H2SдкЫЎШмвКжаЕФЕчРыЃКH2S![]() 2H++ S2Ѓ
2H++ S2Ѓ
C. МзЭщЕФШМЩеШШЮЊ890.3 kJЁЄmolЃ1ЃЌдђМзЭщШМЩеЕФШШЛЏбЇЗНГЬЪНПЩБэЪОЮЊЃКCH4 (g)ЃЋ2O2 (g) ==CO2 (g)ЃЋ2H2O (g) ІЄHЃНЃ890.3 kJЁЄmolЃ1
D. ЬМЫсФЦЫЎНтЕФРызгЗНГЬЪНЃКCO32Ѓ+2H2O![]() 2OHЃ+H2CO3
2OHЃ+H2CO3
ВщПДД№АИКЭНтЮі>>
ПЦФПЃКИпжаЛЏбЇ РДдДЃК ЬтаЭЃК
ЁОЬтФПЁПФГаЫШЄаЁзщЬНОПBa(OH)2ШмвККЭ H2SO4ШмвКЗЂЩњЕФЪЧРызгЗДгІЃЌЩшМЦЕФЪЕбщзАжУКЭЪЕбщВтЖЈЕФЕМЕчадЧњЯпЗжБ№ШчЭМЫљЪОЁЃЯТСагаЙиЫЕЗЈДэЮѓЕФЪЧ
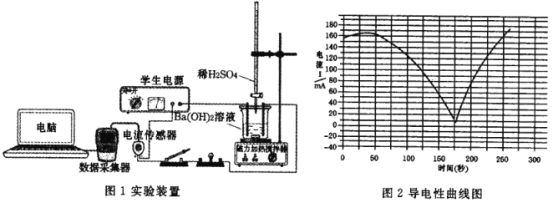
A.ИУЗДгІЕФРызгЗНГЬЪНЪЧ Ba2+ +2OH- +SO42-+2H+=BaSO4Ё§+ 2H2O
B.ЪЕбщЙ§ГЬжаЕЦХнЕФССЖШЗЂЩњБфЛЏПЩвдЫЕУїИУЗДгІЮЊРызгЗДгІ
C.ЕМЕчФмСІзюЕЭЕуБэЪО Ba(OH)2 ШмвККЭ H2SO4ШмвКЧЁКУЭъШЋЗДгІ
D.гУбЮЫсДњЬцH2SO4ШмвКЃЌВтЕУЕФЕМЕчадЧњЯпКЭЩЯЪіЧњЯпЯрЭЌ
ВщПДД№АИКЭНтЮі>>
ПЦФПЃКИпжаЛЏбЇ РДдДЃК ЬтаЭЃК
ЁОЬтФПЁПРызгЕФФІЖћЕчЕМТЪПЩгУРДКтСПЕчНтжЪШмвКжаРызгЕМЕчФмСІЕФЧПШѕЃЌФІЖћЕчЕМТЪдНДѓЃЌРызгдкШмвКжаЕФЕМЕчФмСІдНЧПЁЃвбжЊCa2ЃЋЁЂOHЃЁЂHCO3ЁЊЕФФІЖћЕчЕМТЪЗжБ№ЮЊ0.60ЁЂ1.98ЁЂ0.45ЃЌОнДЫПЩХаЖЯЃЌЯђБЅКЭЕФГЮЧхЪЏЛвЫЎжаЭЈШыЙ§СПЕФЖўбѕЛЏЬМЃЌШмвКЕМЕчФмСІЫцЖўбѕЛЏЬМЭЈШыСПЕФБфЛЏЧїЪЦе§ШЗЕФЪЧ(ЁЁЁЁ)
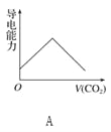
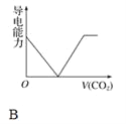

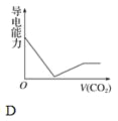
ВщПДД№АИКЭНтЮі>>
ЙњМЪбЇаЃгХбЁ - СЗЯАВсСаБэ - ЪдЬтСаБэ
КўББЪЁЛЅСЊЭјЮЅЗЈКЭВЛСМаХЯЂОйБЈЦНЬЈ | ЭјЩЯгаКІаХЯЂОйБЈзЈЧј | ЕчаХеЉЦОйБЈзЈЧј | ЩцРњЪЗащЮожївхгаКІаХЯЂОйБЈзЈЧј | ЩцЦѓЧжШЈОйБЈзЈЧј
ЮЅЗЈКЭВЛСМаХЯЂОйБЈЕчЛАЃК027-86699610 ОйБЈгЪЯфЃК58377363@163.com