
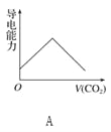
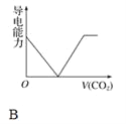
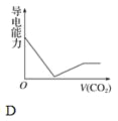
【题目】离子的摩尔电导率可用来衡量电解质溶液中离子导电能力的强弱,摩尔电导率越大,离子在溶液中的导电能力越强。已知Ca2+、OH-、HCO3—的摩尔电导率分别为0.60、1.98、0.45,据此可判断,向饱和的澄清石灰水中通入过量的二氧化碳,溶液导电能力随二氧化碳通入量的变化趋势正确的是( )

【答案】D
【解析】
试题向澄清石灰水中通入CO2,当CO2适量时Ca(OH)2+CO2====CaCO3↓+H2O,其反应的离子方程式为Ca2++2OH-+CO2====CaCO3↓+H2O,当CO2过量时CaCO3+CO2+H2O====Ca(HCO3)2,其反应的离子方程式为CaCO3+CO2+H2O====Ca2++2HC![]() 。所以向澄清石灰水中通入过量的CO2,先生成碳酸钙沉淀,钙离子、氢氧根离子浓度减小,溶液导电能力减弱,后沉淀溶解生成碳酸氢钙溶液,钙离子、碳酸氢根离子的浓度增大,钙离子的浓度与原来相等,碳酸氢根离子的浓度与原来氢氧根离子浓度相等,但OH-的摩尔电导率大于HC
。所以向澄清石灰水中通入过量的CO2,先生成碳酸钙沉淀,钙离子、氢氧根离子浓度减小,溶液导电能力减弱,后沉淀溶解生成碳酸氢钙溶液,钙离子、碳酸氢根离子的浓度增大,钙离子的浓度与原来相等,碳酸氢根离子的浓度与原来氢氧根离子浓度相等,但OH-的摩尔电导率大于HC![]() 的摩尔电导率,所以最后溶液的导电性小于原来的导电性,最后CaCO3全部溶解后,溶液中离子的浓度不再发生变化,即导电能力不再发生变化。
的摩尔电导率,所以最后溶液的导电性小于原来的导电性,最后CaCO3全部溶解后,溶液中离子的浓度不再发生变化,即导电能力不再发生变化。


科目:高中化学 来源: 题型:
【题目】下列离子方程式正确的是( )
A. 铁与FeCl3溶液反应:Fe+Fe3+===2Fe2+
B. Fe与稀盐酸反应:2Fe+6H+===2Fe3++3H2↑
C. FeCl2溶液与Cl2反应:Fe2++Cl2===Fe3++2Cl-
D. Fe(OH)3与盐酸反应:Fe(OH)3+3H+===Fe3++3H2O
【答案】D
【解析】A、电荷不守恒,应为Fe+2Fe3+=3Fe2+,故A错误;B、违反反应事实,应为Fe+2H+=Fe2++H2↑,故B错误;C、电荷不守恒,应为2Fe2++Cl2=2Fe3++2Cl-,故C错误;D、氢氧化铁是难溶物质,不能拆写成离子,发生中和反应,故D正确。
点睛:离子反应方程式正误判断中,一先看是否符合客观事实,二看电荷数是否相等,三看拆写是否正确,四看是否缺少反应。
【题型】单选题
【结束】
6
【题目】把过量铁屑加入FeCl3、CuCl2的混合溶液中,反应结束后,称得剩余固体的质量与所加铁屑的质量相等。则原溶液中FeCl3与CuCl2的物质的量之比是( )
A.7∶2B.3∶2
C.2∶3D.2∶7
查看答案和解析>>
科目:高中化学 来源: 题型:
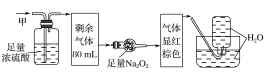
【题目】某无色的混合气体甲中可能含有NO2、NO、CO2、O2、NH3、N2中的几种,将100mL甲气体经过如图所示的实验装置进行处理,结果得到酸性溶液,而几乎无气体剩余,则甲气体的组成为(不考虑Na2O2与NO2、NO的反应)( )
A.NO2、CO2、N2B.NH3、NO、CO2
C.NH3、N2、CO2D.NO、O2、NH3
【答案】B
【解析】
该气体无色,说明其中不含NO2;气体通过浓硫酸体积减小,说明其中有NH3;气体通过足量Na2O2后显红棕色,说明其中含有CO2和NO,故不含O2;最后通入水中无气体剩余,说明其中不存在N2,选项B正确,故答案为B。
【题型】单选题
【结束】
19
【题目】A、B、C、D是四种常见气体单质。E的相对分子质量比F小16,且F为红棕色。有关的转化关系如图所示(反应条件与部分反应的生成物略去)。
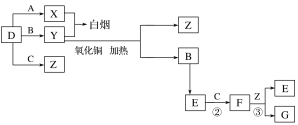
请回答下列问题:
(1)D的化学式为__,Y的化学式为__,E的化学式为__。
(2)Y与氧化铜反应,每生成1molB消耗3mol氧化铜,该反应的化学方程式为__。
(3)Y与E在一定条件下可反应生成B和Z,这是一个具有实际意义的反应,可消除E对环境的污染,该反应的化学方程式为__。
(4)气体F和气体SO2在通常条件下同时通入盛有BaCl2溶液的洗气瓶中(如图所示),洗气瓶中是否有沉淀生成?__,理由是__。
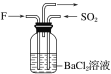
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】燃烧0.1 mol某有机物得0.2 mol CO2和0.3 mol H2O,由此得出的结论不正确的是( )
A. 该有机物分子的结构简式为CH3—CH3
B. 该有机物中碳、氢元素原子数目之比为1∶3
C. 该有机物分子中不可能含有![]() 双键
双键
D. 该有机物分子中可能含有氧原子
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】设NA表示阿伏伽德罗常数的值。下列说法正确的是
A.由H218O与D216O组成的2.0g物质中所含中子、电子数均为NA
B.0.1molFe分别与足量的盐酸和氯气反应,转移的电子数均为0.2NA
C.0.1molAl与足量NaOH溶液反应,生成氢分子数为0.3NA
D.25℃,将0.1molCH3COONa加入稀醋酸至溶液呈中性时,溶液中CH3COO-数小于0.1NA
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】碲(Te)元素是当今新材料的主要成分之一。工业上从电解法精炼铜的阳极泥中提取纯度较高的碲,经预处理后的阳极泥中含TeO2及铁、铅、铜的化合物等,通过以下流程得到:

已知:①TeO2是两性氧化物,微溶于水,可溶于强酸或强碱。
②部分难溶物的Ksp如表:
化合物 | Fe(OH)2 | Pb(OH)2 | Cu(OH)2 | FeS | PbS | CuS |
Ksp | 8×10-16 | 1.2×10-15 | 1.3×10-20 | 4×10-19 | 1×10-28 | 6×10-36 |
回答下列问题:
(1)“碱浸”时TeO2发生反应的化学方程式为___________。
(2)加入Na2S溶液的主要目的是___________。
(3)“沉碲”发生反应的化学方程式为_______。
(4)“酸溶”后,将SO2通入溶液中进行“还原”得到粗碲,该反应的化学方程式是___________。
(5)电解法提纯粗碲时,以Na2TeO3溶液为电解质溶液,阳极材料为___________。电解过程中阴极的电极反应式为___________。
(6)常温下,向0.lmol/LNa2TeO3溶液中滴加盐酸,当溶液pH=5时,溶液中c(TeO32-):c(H2TeO3)=___________。(已知:H2TeO3的Ka1=1.0×10-3Ka2=2.0×10-8)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】按照如图所示装置进行实验,填写有关现象及化学方程式。
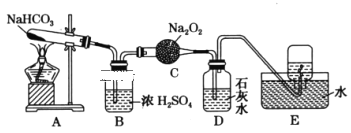
(1)A中现象是___。
(2)B中浓硫酸的作用是___。
(3)C中发生反应的化学方程式为___。
(4)D中的现象是___,发生反应的离子方程式是___。
(5)E中收集的气体是___(填名称)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某强酸性溶液X中可能含有Fe2+、Fe3+、Al3+、Ba2+、NH4+、CO32-、NO3-、SO42-、SiO32-中的若干种,现取X溶液进行连续实验,实验过程及产物如图所示。实验过程中有一种气体为红棕色。
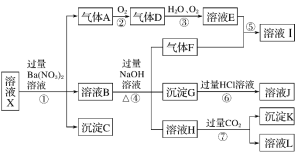
根据以上信息,回答下列问题:
(1)由强酸性条件即可判断X溶液中肯定不存在的离子有________
(2)溶液X中关于硝酸根离子的判断,正确的是______(填编号,下同)。
a.一定含有 b.一定不含有 c.可能含有
(3)化合物I中含有的化学键类型有____________
(4)转化⑦的离子方程式为____________
(5)对不能确定是否存在的离子,可以另取X溶液,加入下列溶液中的一种,根据现象即可判断,该试剂最好是________。
①NaOH溶液 ②KSCN溶液 ③氯水和KSCN的混合溶液 ④pH试纸 ⑤KMnO4溶液
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】常温下,下列各组离子在指定溶液中能大量共存的是( )
A. 无色透明的溶液中:Fe3+、Mg2+、SCN﹣,Cl﹣
B. ![]() =1×10﹣12的溶液中:K+、Na+、CO32﹣、NO3﹣
=1×10﹣12的溶液中:K+、Na+、CO32﹣、NO3﹣
C. 酸性溶液中;Na+、ClO﹣,SO42﹣,I﹣
D. 能溶解Al2O3的溶液中:Na+、Fe2+、HS﹣、SO42﹣
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com