
【题目】按照如图所示装置进行实验,填写有关现象及化学方程式。
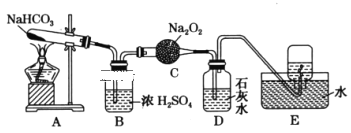
(1)A中现象是___。
(2)B中浓硫酸的作用是___。
(3)C中发生反应的化学方程式为___。
(4)D中的现象是___,发生反应的离子方程式是___。
(5)E中收集的气体是___(填名称)。
【答案】试管口有无色液体生成 干燥CO2气体 2CO2+2Na2O2=2Na2CO3+O2 石灰水变浑浊 CO2+Ca2++2OH-=CaCO3↓+H2O 氧气
【解析】
(1)碳酸氢钠受热分解生成碳酸钠、水和二氧化碳;
(2)根据浓硫酸的性质分析;
(3)根据过氧化钠的性质分析;
(4)根据二氧化碳和石灰水的性质分析;
(5)根据反应后可能剩余的气体分析。
(1)碳酸氢钠受热分解生成碳酸钠、水和二氧化碳,则可观察到A中试管口有无色液体生成;
故答案为:试管口有无色液体生成;
(2)浓硫酸有吸水性,所以能作干燥剂,二氧化碳和浓硫酸不反应,所以能用浓硫酸干燥二氧化碳;
故答案为:干燥CO2气体;
(3)二氧化碳和过氧化钠反应生成碳酸钠和氧气,反应的化学方程式为:2Na2O2+2CO2=2Na2CO3+O2;
故答案为:2Na2O2+2CO2=2Na2CO3+O2;
(4)二氧化碳能使澄清的石灰水变浑浊,所以未与过氧化钠反应的二氧化碳使石灰水变浑浊,发生反应的离子方程式为:CO2+Ca2++2OH-=CaCO3↓+H2O;
故答案为:石灰水变浑浊;CO2+Ca2++2OH-=CaCO3↓+H2O;
(5)碳酸氢钠分解生成的水蒸汽被浓硫酸吸收,未与过氧化钠反应的二氧化碳被石灰水吸收,所以剩余的气体就是二氧化碳和过氧化钠反应生成的氧气;
故答案为:氧气。


 智能训练练测考系列答案
智能训练练测考系列答案 计算高手系列答案
计算高手系列答案科目:高中化学 来源: 题型:
【题目】下列有关化学符号表征正确的是
A. 电解法精炼铜,阴极电极反应:Cu2++2e-== Cu
B. H2S在水溶液中的电离:H2S![]() 2H++ S2-
2H++ S2-
C. 甲烷的燃烧热为890.3 kJ·mol-1,则甲烷燃烧的热化学方程式可表示为:CH4 (g)+2O2 (g) ==CO2 (g)+2H2O (g) ΔH=-890.3 kJ·mol-1
D. 碳酸钠水解的离子方程式:CO32-+2H2O![]() 2OH-+H2CO3
2OH-+H2CO3
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某研究性学习小组欲探究原电池的形成条件,按下图所示装置进行实验
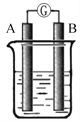
序号 | A | B | 烧杯中的液体 | 指针是否偏转 |
1 | Zn | Cu | 稀硫酸 | 有 |
2 | Zn | Zn | 稀硫酸 | 无 |
3 | Cu | C | 氯化钠溶液 | 有 |
4 | Mg | Al | 氢氧化钠溶液 | 有 |
分析上述数据,回答下列问题:
(1)实验1中电流由________极流向_______ 极(填“A”或“B”)
(2)实验4中电子由B极流向A极,表明负极是_________电极(填“镁”或“铝”)
(3)实验3 表明 ______
A.铜在潮湿空气中不会被腐蚀 B.铜的腐蚀是自发进行的
(4)分析上表有关信息,下列说法不正确的是____________
A.相对活泼的金属一定做负极
B.失去电子的电极是负极
C.烧杯中的液体,必须是电解质溶液
D.浸入同一电解质溶液中的两个电极,是活泼性不同的两种金属(或其中一种非金属)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】离子的摩尔电导率可用来衡量电解质溶液中离子导电能力的强弱,摩尔电导率越大,离子在溶液中的导电能力越强。已知Ca2+、OH-、HCO3—的摩尔电导率分别为0.60、1.98、0.45,据此可判断,向饱和的澄清石灰水中通入过量的二氧化碳,溶液导电能力随二氧化碳通入量的变化趋势正确的是( )
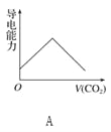
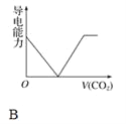

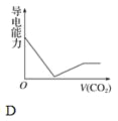
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】金属钠是在1807年通过电解氢氧化钠制得的,这个原理应用于工业生产,约在1891年才获得成功。1921年实现了电解氯化钠制钠的工业方法,其反应原理是:2NaCl(熔融)![]() 2Na+Cl2↑。回答下列有关单质钠的问题:
2Na+Cl2↑。回答下列有关单质钠的问题:
(1)下列各项中属于保存金属钠的正确方法是___。
A.放在棕色瓶中 B.放在细沙中 C.放在水中 D.放在煤油中
(2)钠长时间放在空气中,最后的产物主要成分是___。
A.Na2O B.Na2O2 C.NaOH D.Na2CO3
(3)将一小块钠放在水平放置的试管中部,用酒精灯加热充分反应(如图Ⅰ所示),请写出该反应的化学方程式___,生成物的颜色为___。将该试管冷却后直立,滴加几滴水(如图Ⅱ所示),发生反应的离子方程式为___,检验该反应产生的气体的方法是___。
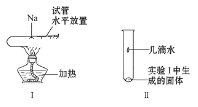
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列反应能用离子方程式2H+ + CO32-=CO2↑ + H2O表示的是
A.HCl溶液与MgCO3反应
B.CH3COOH与K2CO3溶液反应
C.HNO3溶液与NaHCO3溶液反应
D.H2SO4溶液与(NH4)2CO3溶液反应
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】现有一份含有FeCl3和FeCl2的固体混合物,某化学兴趣小组为测定各成分的含量进行如下两个实验:
实验1 ①称取一定质量的样品,将样品溶解;
②向溶解后的溶液中加入足量的AgNO3溶液,产生沉淀;
③将沉淀过滤、洗涤、干燥得到白色固体28.7 g
实验2 ①称取与实验1中相同质量的样品,溶解;
②向溶解后的溶液中通入足量的Cl2;
③再向②所得溶液中加入足量的NaOH溶液,得到红褐色沉淀;
④将沉淀过滤、洗涤后,加热灼烧到质量不再减少,得到固体Fe2O36.40g
根据实验回答下列问题:
(1)溶解过程中所用到的玻璃仪器有________
(2)实验室保存FeCl2溶液时通常会向其中加入少量的铁粉,其作用是_________
(3)用化学方程式表示实验2的步骤②中通入足量Cl2的反应:___________
(4)用容量瓶配制实验所用的NaOH溶液,下列情况会使所配溶液浓度偏高的是(填序号)_______。
a.未冷却溶液直接转移
b.没用少量蒸馏水洗涤烧杯和玻璃棒2~3次并转入容量瓶
c.加蒸馏水时,不慎超过了刻度线
d.砝码上沾有杂质
e.容量瓶使用前内壁沾有水珠
(5)检验实验2的步骤④中沉淀洗涤干净的方法是___________
(6)该小组每次称取的样品中含有FeCl2的质量为_________g
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】(1)3.01×1023个NH4+含有质子的物质的量是______mol,含有电子的物质的量是______mol。
(2)200mL 2mol/L的Al2(SO4)3 溶液中SO42-的物质的量浓度为_________。
(3)标准状况下36g H2和O2组成的混合气体的体积是67.2L 。求这种混合气体中H2和O2的体积比为____________。
(4)同温同压下,质量比为17:48的NH3和CH4两种气体,密度之比为_________。
(5)已知1.505×1023个A气体分子质量为31g ,则A气体的摩尔质量是_________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列有关同分异构体数目的叙述错误的是( )
A. 甲苯苯环上的一个氢原子被含3个碳原子的烷基取代,所得产物有6种
B. 有机物C7H8O属于芳香族化合物的同分异构体有6种
C. 立体烷![]() 的二氯代物有3种
的二氯代物有3种
D. 菲的结构简式为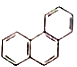 ,它的一硝基取代物有5种
,它的一硝基取代物有5种
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com