
【题目】将5g某金属加入到100mL 2mol L-1的硫酸溶液中,当硫酸浓度降低到原浓度的一半时(设溶液体积不变),金属还没有全部溶解。该金属可能是
A.AlB.ZnC.FeD.Na
【答案】A
【解析】
依题意,100mL 2mol L-1的硫酸为0.2mol,浓度降为一半时,参加反应的硫酸为0.1mol,而金属溶解的质量小于5g,若金属完全溶解,则消耗硫酸的物质的量>0.1mol。
设金属的相对分子质量为M,与硫酸反应时,表现的化合价为x,从而得出:
![]() ,M<25x。
,M<25x。
A. 当x=3时,M<25×3,而Al的相对原子质量为27,A符合题意;
B. 当x=2时,M<25×2,而Zn的相对原子质量为65,B不合题意;
C.当x=2时,M<25×2,而Fe的相对原子质量为56,C不合题意;
D. 当x=1时,M<25,虽然M(Na)=23,看似符合题意,但实际上,钠不可能有剩余,所以D不合题意。
故选A。


 一课一练一本通系列答案
一课一练一本通系列答案 浙江之星学业水平测试系列答案
浙江之星学业水平测试系列答案科目:高中化学 来源: 题型:
【题目】实验室可用KMnO4和浓盐酸反应制取氯气,其变化可表述为2KMnO4+16HCl(浓)=2KCl+2MnCl2+5Cl↑2+8H2O。
(1)请将上述化学方程式改写为离子方程式:__。
(2)浓盐酸在反应中显示出来的性质是__(填编号)。
①只有还原性②还原性和酸性③只有氧化性④氧化性和酸性
(3)此反应中氧化产物是Cl2,若产生0.5molCl2,则转移电子的物质的量为__mol。
(4)用双线桥法表示该反应电子转移的方向和数目__。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】以含镍废硫酸盐(含 Ni2+ 、Fe2+ 、Cu2+ 、Co2+ 、A13+ 、Mn2+ 、Cr3+ 、Mg2+ 、Zn2+ 等)为原料制取NiSO4·6H2O 的工艺流程如下:
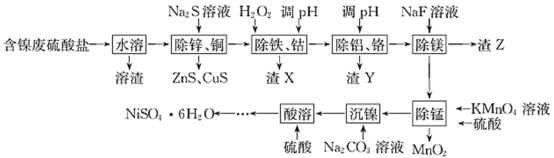
相关金属离子形成氢氧化物沉淀的pH 范围如下:
金属离子 | Co2+ | Co3+ | Fe2+ | Fe3+ | A13+ | Cr3+ | Ni2+ |
开始沉淀的pH | 7.2 | 0.23 | 6.3 | 1.5 | 4.1 | 4.3 | 6.9 |
沉淀完全的pH | 9.2 | 1.1 | 8.3 | 2.8 | 5.4 | 5.6 | 8.9 |
回答下列问题:
(1)已知1gKsp(CuS)= -47.6,1gKsp(ZnS)= -23.8,则反应ZnS+Cu2+![]() CuS+Zn2+的平衡常数对数值1gK= ________________________。
CuS+Zn2+的平衡常数对数值1gK= ________________________。
(2)“除铁、钴”时,加入H2O2的目的是 ______________,得到的渣X为________。
(3) “除铝、铬”时,调pH 范围为 _________;滤渣Y 中含Cr(OH)3,其性质与 A1(OH)3 类似,写出Cr(OH)3与NaOH反应的化学方程式: __________________。
(4)“除锰”时,发生反应的离子方程式为___________________________。
(5)“酸溶”得到溶液制备 NiSO4·6H2O晶体,还需进行的操作工艺是___________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下图是由常见元素组成的一些单质及其化合物之间的转化关系图。各方框表示有关的一种反应物或生成物(部分物质已经略去)。其中A、B、D在常温下均为无色无味的气体,C是能使湿润的红色石蕊试纸变蓝的气体,M是最常见的无色液体。

(1)写出C→E的化学方程式: 。
(2)实验室常用加热两种固体混合物的方法制备物质C,其化学方程式为: ,干燥C常用 (填写试剂名称)。
(3)E物质遇到D物质时,会观察到 现象,若用排水法收集F,则最终集气瓶中收集到的气体为 (填写物质的化学式)。
(4)写出A→D的化学方程式: 。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】X、Y、Z、W有如图所示的转化关系,则X、Y可能是
①C,CO ②AlCl3、Al(OH)3 ③Na、Na2O ④NaOH、Na2CO3 ⑤AlO2-,Al(OH)3 ⑥Fe FeCl2
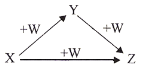
A.①②⑥B.①②③④⑤C.①②③④⑤⑥D.①②④
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】科学家制造出一种使用固态电解质的燃料电池,其效率更高,可用于航天航空。如图1所示装置中,以稀土金属材料作为惰性电极,在电极上分别通入CH4和空气,其中固态电解质是掺杂了Y2O3的ZrO2固体,它在高温下能传导O2-(O2+4e-=2O2-)。
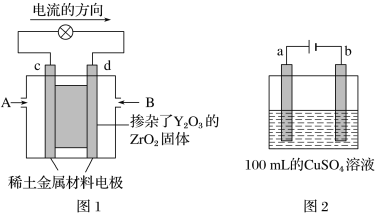
(1)c电极的名称为________(填“正极”或“负极”),d电极上的电极反应式为: ____。
(2)如图2所示用惰性电极电解100 mL 0.5 mol·L-1CuSO4溶液,a电极上的电极反应式为: __________,若a电极产生56 mL(标准状况)气体,则所得溶液的c(H+)=________(不考虑溶液体积变化),若要使电解质溶液恢复到电解前的状态,可加入________(填字母)。
a.CuO b.Cu(OH)2 c.CuCO3 d.Cu2(OH)2CO3
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】二甲醚和乙醇是两种常见的有机溶剂,也可作为新能源。
(1)通过以下反应可获得二甲醚(CH3OCH3):
①CO(g)+H2O(g)=CO2(g)+H2(g) ΔH 1=a kJ·molˉ1
②CO2(g)+3H2(g)=CH3OH(g)+H2O(g) ΔH 2=b kJ·molˉ1
③2CH3OH(g)=CH3OCH3(g)+H2O(g) ΔH 3=c kJ·molˉ1
则反应 2CO(g)+4H2(g)=CH3OCH3(g)+H2O(g)的 ΔH=_________kJ·molˉ1。
(2)已知气相直接水合法可以制取乙醇:H2O(g)+C2H4(g) ![]() CH3CH2OH(g)。
CH3CH2OH(g)。
在 n(H2O)∶n(C2H4)=1∶1 的条件下投料,乙烯的平衡转化率与温度(T)及压强(p) 的关系如图1所示。
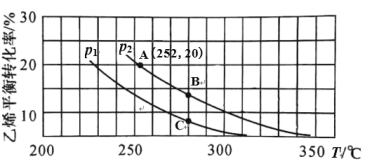 图1
图1
①下列有关说法中正确的是_________。
A.p1>p2 B.280℃时,vB>vC
C.A、B、C 三点的平衡常数 KA>KB>KC D.低温有利于该反应自发进行
②在 p2,280℃条件下,C 点的 v 正 ____v 逆 (填“>”、“<”或“=”),理由是________。
③计算图 1 中 A 点的平衡常数 Kp=_________。(结果用 p2 的代数式表示,平衡分压代替平衡浓度计算,分压=总压×物质的量分数)
(3)在 n(H2O)∶n(C2H4)=1∶x 的条件下投料,某研究小组在压强为 p2,温度为 252℃ 时,进行平衡体系中乙醇的体积分数随投料比变化的测定实验。在图 2 中画出平衡体系中乙醇的体积分数 φ 随 x 变化的示意图____。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列热化学方程式或离子方程式中,正确的是
A. 0.01mol·L﹣1NH4Al(SO4)2溶液与0.02mol·L﹣1Ba(OH)2溶液等体积混合:NH4++Al3++2SO42﹣+2Ba2++4OH﹣═2BaSO4↓+Al(OH)3↓+NH3·H2O
B. 一定条件下,将0.5mol N2(g)和1.5molH2(g)置于密闭的容器中充分反应生成NH3(g),放热19.3kJ,其热化学方程式为:N2(g)+3H2(g)![]() 2NH3(g)△H=﹣38.6kJ·mol﹣1
2NH3(g)△H=﹣38.6kJ·mol﹣1
C. H2(g)+![]() O2(g)═H2O(g)△H=﹣285.8kJ·mol﹣1,则H2的燃烧热为285.8 kJ·mol﹣1
O2(g)═H2O(g)△H=﹣285.8kJ·mol﹣1,则H2的燃烧热为285.8 kJ·mol﹣1
D. CO(g)的燃烧热是283.0 kJ·mol﹣1,则CO2分解的热化学方程式为:2CO2(g)═2CO(g)+O2(g)△H=+283.0 kJ·mol﹣1
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】化学反应原理对化学反应的研究具有指导意义。
(1)机动车废气排放已成为城市大气污染的重要来源。
①气缸中生成NO的反应为:N2(g)+O2(g)![]() 2NO(g)△H>0。汽车启动后,气缸内温度越高,单位时间内NO排放量越大,请分析两点原因。A_____;B______。
2NO(g)△H>0。汽车启动后,气缸内温度越高,单位时间内NO排放量越大,请分析两点原因。A_____;B______。
②汽车汽油不完全燃烧时还产生CO,若设想按下列反应除去CO:2CO(g)=2C(s)+O2(g) △H>0,该设想能否实现?____(选填“能”或“不能”),依据是____。
(2)一定条件下,Fe3+和I﹣在水溶液中的反应是2I﹣+2Fe3+![]() I2+2Fe2+,当反应达到平衡后,加入CCl4充分振荡,且温度不变,上述平衡向____(选填“正反应”或“逆反应”)方向移动。请设计一种使该反应的化学平衡逆向移动的简单的实验方案____。
I2+2Fe2+,当反应达到平衡后,加入CCl4充分振荡,且温度不变,上述平衡向____(选填“正反应”或“逆反应”)方向移动。请设计一种使该反应的化学平衡逆向移动的简单的实验方案____。
(3)已知:①CH3OH(g)+![]() O2(g)=CO2(g)+2H2O(g) ΔH=-akJ·mol-1
O2(g)=CO2(g)+2H2O(g) ΔH=-akJ·mol-1
②CH4(g)+2O2(g)=CO2(g)+2H2O(g) ΔH=-bkJ·mol-1
③CH4(g)+2O2(g)=CO2(g)+2H2O(l) ΔH=-ckJ·mol-1
则下列叙述正确的是______
A.由上述热化学方程式可知b>c
B.甲烷的燃烧热为bkJ·mol-1
C.2CH3OH(g)=2CH4(g)+O2(g) ΔH=2(b-a)kJ·mol-1
D.若甲醇和甲烷的物质的量之比为1∶2,其完全燃烧生成CO2和H2O(l)时放出的热量为QkJ,则该混合物中甲醇的物质的量为![]() mol
mol
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com